Sommaire
Introduction
Présentation générale
Utilisation pratique
Apprendre le tableau
Dans ce chapitre nous allons un outil très important : le tableau de Mendeleïev. Il sert beaucoup dans le chapitre sur les atomes, ce pourquoi tu es fortement encouragé à lire le chapitre sur les atomes avant, notamment pour comprendre le vocabulaire utilisé ci-dessous.
Nous parlerons également dans ce chapitre de la règle du duet et de l’octet, ce pourquoi tu es invité à lire (ou relire) le chapitre sur les ions qui traite de cela.
Remarque importante : dans le chapitre ci-dessous nous parlerons de la configuration électronique avec les couches K, L et M pour simplifier. Avec la réforme, la configuration électronique est vue de manière différente, qui est abordée dans le chapitre sur les ions.
Le tableau de Mendeleïev, du nom de son inventeur, permet surtout de connaître le numéro atomique (le Z) et la masse molaire des atomes que tu auras à étudier dans les exercices. Ce tableau est présent dans le rabat de ton livre de physique, tu es donc invité à prendre ton livre afin d’avoir le tableau sous les yeux, en plus grande taille que ce qui suit 
Comme on dit toujours, rien ne vaut un bon schéma ! Voici donc à quoi ressemble le tableau de Mendeleïev, aussi appelé tableau périodique ou tableau périodique des éléments :
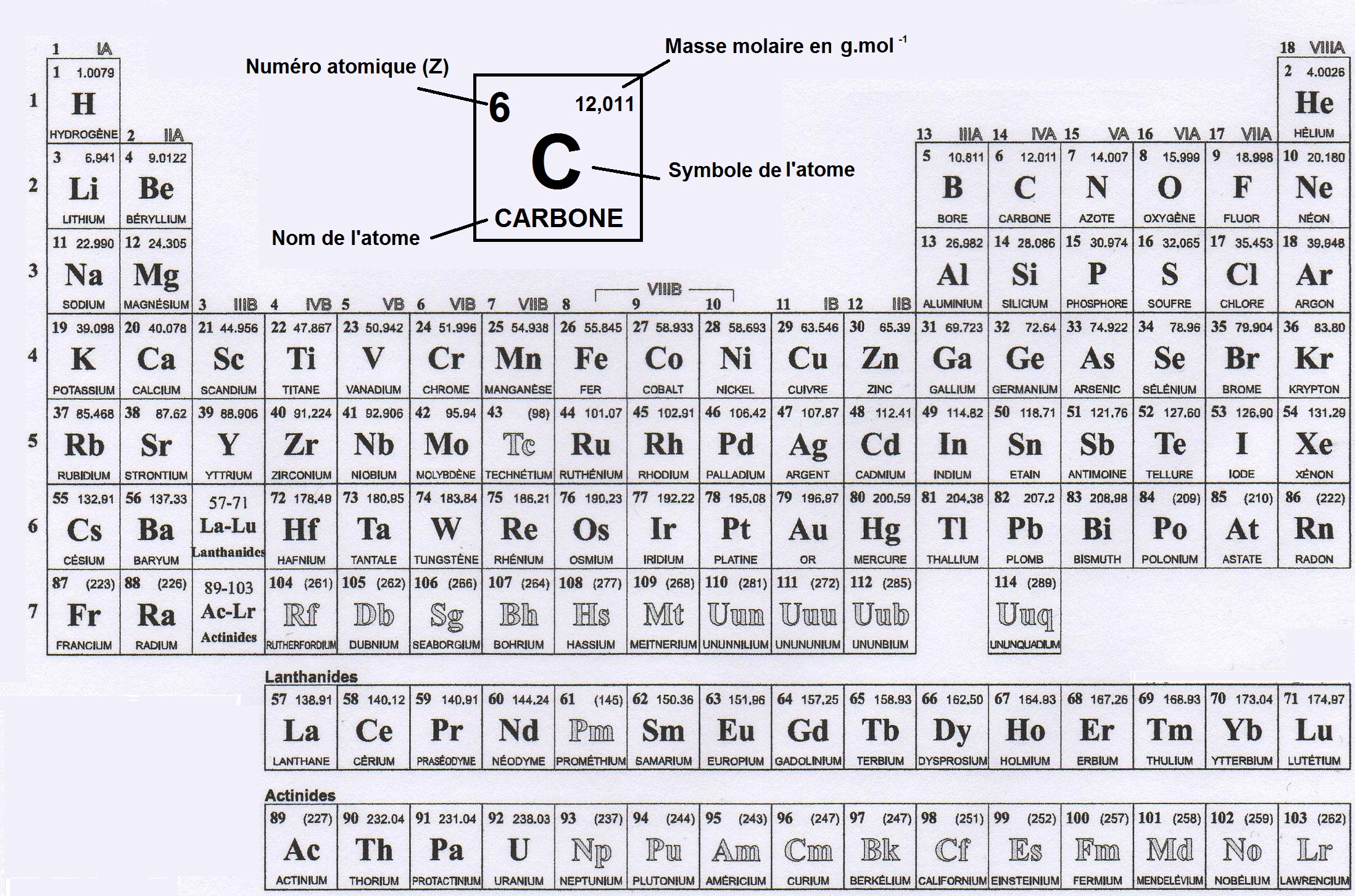
Comme tu le vois il s’agit d’un tableau où chaque case correspond à un atome.
Dans chaque case on trouve des informations comme le symbole, le nom, le numéro atomique ou la masse molaire (que l’on verra dans un autre chapitre).
Mais la position de la case dans le tableau donne également de précieuses informations.
Il faut donc savoir se positionner dans le tableau, et pour cela, un peu de vocabulaire ne fera pas de mal.
Au lycée tu ne verras que les trois premières lignes donc certains schémas suivants seront simplifiés et ne feront apparaître que ces lignes.
Ce qui est important ce sont les lignes et les colonnes :
—
Une colonne du tableau est appelée une famille.
Une ligne du tableau est appelée une période.
—
—
Les éléments d’une même famille (d’une même colonne) ont des propriétés chimiques identiques (cette question tombe souvent en question de cours).
—
Les familles ont toutes des noms mais tu ne dois en retenir que 4, les 2 premières et les 2 dernières

(le nombre de colonnes a été raccourci pour plus de visibilité)
Comme tu le vois, la 1ère colonne correspond aux alcalins (famille des alcalins)
La 2ème colonne correspond aux alcalino-terreux.
L’avant-dernière colonne correspond aux halogènes.
La dernière colonne correspond aux gaz rares, aussi appelés gaz nobles.
Retiens bien ces noms car cela pourra t’être demandé dans les exercices !
Concernant les lignes, chaque ligne correspond au remplissage d’une couche électronique.
Mais qu’est-ce-que cela signifie ? 
Tout simplement que les éléments de la 1ère ligne (1ère période) ont une configuration électronique de type (K)1 ou (K)2 ;
Les éléments de la 2ème ligne (2ème période) ont une configuration électronique de type (K)2(L)1, (K)2(L)2…(K)2(L)8 ;
Les éléments de la 3ème ligne (3ème période) ont une configuration électronique de type (K)2(L)8(M)1, (K)2(L)8(M)2…(K)2(L)8(M)8
Comme d’habitude un petit schéma récapitulatif 
On va voir maintenant comment utiliser le tableau dans les exercices.
Tout d’abord nous allons étudier chaque case du tableau qui se compose de la manière suivante :
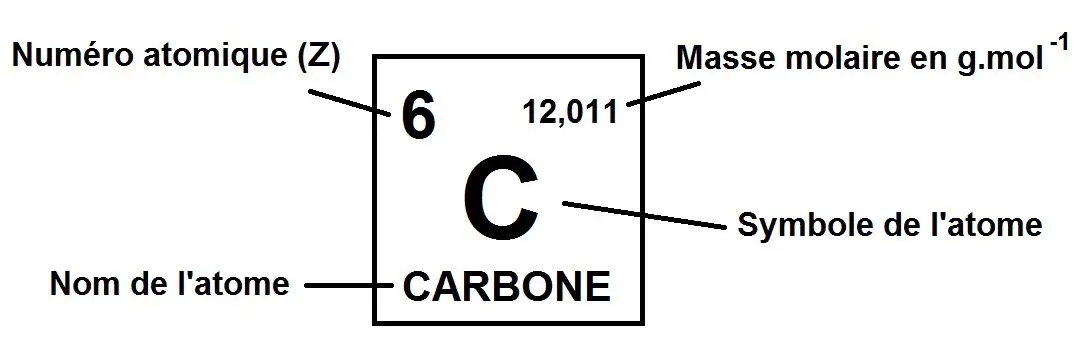
Comme tu le vois, on a plein d’informations sur l’atome qui vont permettre de faire différents calculs comme expliqué dans le chapitre sur les atomes.
De toute façon sur le tableau qu’on te donne il y a ce genre de schéma qui est en fait une légende du tableau comme sur une carte en géographie donc tu n’as pas besoin d’apprendre le schéma ci-dessus par coeur.
Maintenant nous allons voir une information importante par rapport aux familles (les colonnes).
Petite remarque avant d’aller plus loin : on a vu que l’on s’intéressait aux trois premières lignes. Or comme tu l’as remarqué il y a un « espace vide » entre les 2 premières colonnes et les autres :
Nous appellerons donc TROISIÈME colonne celle composée de B et Al, qui est en fait la 13ème colonne du tableau complet.
De même, nous appellerons QUATRIÈME colonne celle composée de C et Si, qui est en fait la 14ème colonne du tableau complet etc…
Ainsi, si tu fais la configuration électronique des atomes de la première colonne (H, Li et Na), tu remarqueras qu’ils ont UN électron sur leur couche EXTERNE.
De même, les atomes de la deuxième colonne (Be et Mg) ont DEUX électrons sur leur couche EXTERNE.
Les atomes de la troisième colonne (B et Al) ont TROIS électrons sur leur couche EXTERNE.
Les atomes de la quatrième colonne (C et SI) ont QUATRE électrons sur leur couche EXTERNE.
Etc etc …
Facile à retenir 
Exception : le He de la dernière colonne a 2 électrons sur sa couche externe. On en reparle plus loin.
Comment utiliser cette particularité ?
Pour cela il faut avoir lu le chapitre sur les ions.
D’après ce chapitre et ce que l’on vient de dire, les éléments d’une même colonne vont tous perdre ou gagner le même nombre d’électrons pour respecter la règle du duet ou de l’octet et vont donc tous avoir la même charge quand ils deviendront des ions !!
Et en plus, leur colonne d’appartenance te donne le nombre d’électrons qu’ils vont perdre ou gagner.
Ainsi les atomes de la 1ère colonne vont donner H+, Li+, Na+ ;
Les atomes de la 2ème colonne vont donner Be2+, Mg2+ ;
Les atomes de la 3ème colonne vont donner B3+, Al3+ ;
Les atomes de la 4ème colonne… ne se transforment généralement pas en ions !
Les atomes de la 5ème colonne vont donner N3-, P3- ;
Les atomes de la 6ème colonne vont donner O2-, S2- ;
Les atomes de la 7ème colonne vont donner F–, Cl– ;
Les atomes de la 8ème colonne… sont stables donc ne se transforment pas en ions !
Oui mais comment se servir de cela ?
Et bien par exemple on te demande de trouver l’ion que va donner le chlore (Cl), tu trouves Cl– (en faisant sa configuration électronique etc…).
On te demande d’en déduire quel ion va donner le fluor (F) qui est de la même famille.
Il y a juste à dire que F est de la même famille que Cl donc a les mêmes propriétés chimiques, donc comme Cl donne Cl–, F devient F–, tout simplement !
De même pour les autres atomes de la famille des halogènes.
Remarque : on a dit que le He était une exception car il est situé sur la 8ème colonne mais possède seulement 2 électrons sur sa couche externe.
En fait, c’est parce que He respecte le règle du duet et non de l’octet comme les autres atomes de la dernière colonne.
En effet, les gaz rares (dernière colonne) ont leur dernière couche saturée(c’est d’ailleurs pour cela qu’ils sont stables et ne se transforment pas en ions). Pour les deuxièmes et troisièmes lignes la dernière couche est L ou M qui peuvent contenir 8 électrons, mais pour la première ligne c’est la couche K qui ne peut en avoir que 2 ! Donc pour être saturée la couche externe de He aura 2 électrons et non 8, d’où l’exception.
Autres utilisation possible du tableau : l’électronégativité.
Mais qu’est-ce-que c’est que ce nom barbare ??
L’électronégativité, c’est la capacité d’un atome à attirer vers lui un doublet liant qui le relie à un autre atome (si tu ne sais pas ce qu’est un doublet liant, va voir le chapitre sur les molécules).
En fait, quand on a un doublet liant entre deux atomes, il ne va pas être au milieu mais sera décalé vers l’un des deux atomes.
Oui mais lequel ??
Tout simplement vers le plus électronégatif !
Pour savoir quel atome est le plus électronégatif, il faut savoir lequel est le plus « en haut à droite » dans le tableau.
On va prendre des exemples sur les trois premières lignes du tableau :
Le Fluor (F) est plus en haut et plus à droite que le Silicium (Si), donc F est plus électronégatif que Si.
Donc s’il y a un doublet liant entre F et Si, il sera plus vers F que vers Si :
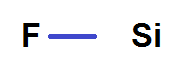
De même, N est au-dessus de P, donc le doublet entre N et P sera décalé vers N
Cl est à droite de Mg, donc le doublet entre Cl et Mg sera décalé vers Cl.
Oui mais si on a deux atomes dont l’un est plus en haut mais plus à gauche ???
Par exemple Be et S.
En effet, cela pose problème car S est plus à droite donc devrait être plus électronégatif, mais Be est plus en haut donc devrait être plus électronégatif : les deux règles se compensent 
A ce moment-là on ne peut pas savoir avec le tableau lequel est le plus électronégatif.
Par contre on te donnera dans l’énoncé la valeur de l’électronégativité de chaque atome, comme ça tu pourras voir lequel est le plus électronégatif !
—
ATTENTION !! Il existe des exceptions, certains atomes plus en haut ou plus à droite que d’autres sont moins électronégatifs, mais si c’est le cas la valeur de l’électronégativité sera donnée dans l’énoncé.
—
Au lycée tu ne verras généralement que les trois premières lignes du tableau. Normalement tu ne dois pas les apprendre par cœur mais on ne sait jamais 
Pour la première ligne tu retiens par coeur que c’est l’hydrogène H et l’hélium He, tu peux bien retenir ça par cœur.
Pour les 2 autres lignes il y a un moyen mnémotechnique très simple : tu associes chaque symbole de l’atome à un mot, et tu vas apprendre une phrase pour chaque ligne. Reprenons les lignes que tu dois connaître :
Pour le 2ème ligne : LIli BEcha Bien Chez Notre Oncle François-NEstor
LIli donne Li, BEcha donne Be, Bien donne B, etc… et on retrouve Li Be B C N O F Ne
Pour la 3ème ligne : NApoléon ManGe ALlègrement SIx Poulets Sans CLaquer d’ARgent
Ce qui donne Na Mg Al Si P S Cl Ar.
Evidemment tu peux trouver d’autres phrases, la seule limite est ton imagination !
Tu sais désormais tout ce qu’il faut savoir sur le tableau périodique de Mendeleïev 



Je suis retraité. Je me remets à la physique et aux maths. Cela fait des années que je cherche un site comme le vôtre !
Tout est clair, je peux prendre des notes, faire des exercices à mon rythme. Au départ, je cherchais des livres, mais ne trouvais rien.
Bref, continuez svp.
Merci pour votre commentaire ! Bon courage pour la suite 🙂
rien a dire parfait.
la couche M ne va t’elle pas jusqu’a 18 électrons ?
Oui tout à fait !
Il y a une erreur dans l’exemple donné avec F pour expliquer l’électronégativité : vous parlez de doublet non liant alors qu’il s’agit d’un doublet liant entre F et Si.
Sinon, merci pour la simplicité et la limpidité de vos explications !!!
Merci ! L’erreur a été corrigée 🙂