Sommaire
Introduction
Couches électroniques et configuration électronique
Position d’un atome dans le tableau périodique
Règles du duet et de l’octet
Configuration électronique avec K, L, M
Conclusion
Exercices
Pour comprendre ce chapitre il faut tout d’abord que tu aies bien lu le cours sur les atomes.
Il faut également que tu aies vu le cours sur le tableau périodique.
Nous allons voir que les atomes ne restent par toujours sous forme d’atome mais peuvent se transformer en ions.
C’est un chapitre très important qui est complémentaire du cours sur le tableau de Mendeleïev.
Tu dois te souvenir que les électrons gravitent autour du noyau dans l’atome. Mais ils ne gravitent pas n’importe comment, ils forment des cercles concentriques de différents rayons autour du noyau de la façon suivante :
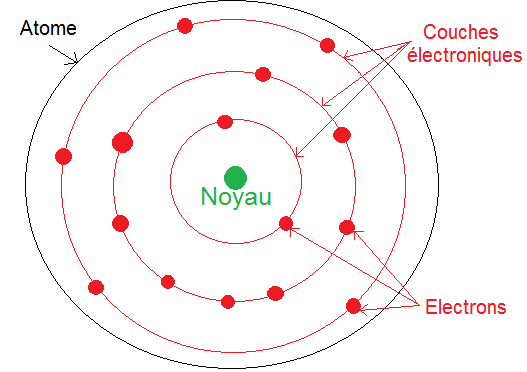
Il faut bien sûr imaginer cela en 3D.
Chaque cercle représente une couche électronique (sauf le cercle extérieur qui représente la limite de l’atome).
Elle sont notées 1, 2, 3 etc…. Au lycée tu n’étudieras que les 3 premières couches, les autres sont vues après le bac.
Chaque couche est composée de sous-couches notées s, p etc…
Au lycée tu ne verras que les sous-couches s et p.
—
La sous-couche s ne peut contenir que 2 électrons.
La sous-couche p ne peut contenir que 6 électrons.
—
Ces couches et ces sous-couches correspondent aux éléments dans le tableau périodique, sauf qu’ici, exceptionnellement, l’hélium qui normalement est tout en haut à droite va se retrouver à gauche :
Comme tu le vois, la première couche correspond à la 1ère ligne, la 2ème couche à la 2ème ligne etc…
Le bloc s correspond aux 2 premières colonnes, le bloc p aux 6 dernières (ce pourquoi la sous-couche s ne peut contenir que 2 électrons et la sous-couche p ne peut contenir que 6 électrons).
—
On a donc les sous-couches 1s, 2s, 2p, 3s et 3p.
Pour trouver ce que l’on appelle la configuration électronique d’un atome, on va remplir progressivement et dans cet ordre ces sous-couches, en mettant en puissance le nombre d’électrons que l’on met.
—
Et on ne passe pas à la sous-couche suivante tant que l’on n’a pas rempli la sous-couche d’avant !! 
Imaginons que l’on ait 16 électrons :
on met 2 électrons sur la sous-couche 1s, donc 1s2 (il n’en reste plus que 14)
on met 2 électrons sur la sous-couche 2s, donc 2s2 (il n’en reste plus que 12)
on met 6 électrons sur la sous-couche 2p, donc 2p6 (il n’en reste plus que 6)
on met 2 électrons sur la sous-couche 3s, donc 3s2 (il n’en reste plus que 4)
on met 4 électrons sur la sous-couche 3p, donc 3p4 (il ne reste plus d’électrons)
La configuration électronique d’un atome possédant 16 électrons est alors :
1s2 2s2 2p6 3s2 3p4
Si dans un exercice on te demande la configuration électronique de l’atome, tu devras répondre quelque chose comme 1s2 2s2 2p3 ou 1s2 2s2 2p6 3s1 par exemple.
Tu remarqueras évidemment que l’on n’est pas obligé de remplir toutes les sous-couches électroniques :
Si on a 3 électrons, cela donnera 1s2 2s1
Si on a 9 électrons, cela donnera 1s2 2s2 2p5
Evidemment, avant de faire la configuration électronique d’un atome il faut connaître son nombre d’électrons, mais ça tu as appris à le faire dans le chapitre sur les atomes 
Remarque : au lycée tu auras au maximum 18 électrons dans les exercices, donc au maximum tu auras 1s2 2s2 2p6 3s2 3p6.
Au-delà de 18 électrons il y a des règles un peu différentes que nous n’aborderons pas ici.
Grâce à la configuration électronique d’un atome, on peut connaître sa position dans le tableau périodique et vice-versa.
En effet, imaginons qu’on ait la configuration électronique :
1s2 2s2 2p6 3s2 3p4.
On regarde alors la dernière sous-couche remplie, ici 3p4.
3p4 signifie que l’atome est sur la 3ème ligne, dans le bloc p, à la 4ème colonne du bloc p :
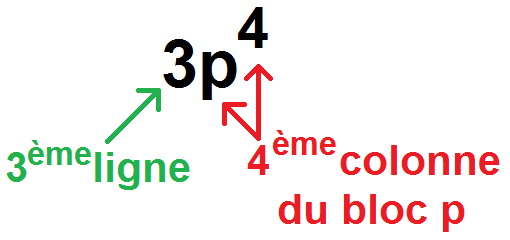
Et en effet, 1s2 2s2 2p6 3s2 3p4 donne 16 électrons, qui correspond au soufre, qui est bien à la 3ème ligne, dans la 4ème colonne du bloc p :
Autre exemple :
1s2 2s1
La dernière sous-couche remplie est 2s1, donc cet atome est sur la 2ème ligne, dans la 1ère colonne du bloc s :
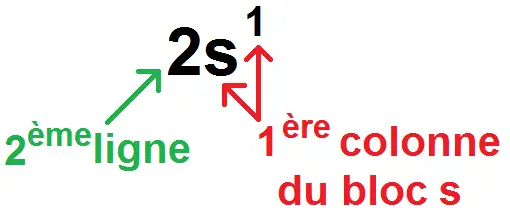
Et en effet, 1s2 2s1 donne 3 électrons, qui correspond au lithium, qui est bien à la 2ème ligne, dans la 1ère colonne du bloc s.
Dans le même ordre d’idée, les éléments d’une même colonne forment une famille chimique, c’est-à-dire qu’elles ont des propriétés chimiques identiques (cela peut t’être demandé en question de cours).
De plus, ces éléments d’une même colonne ont le même nombre d’électrons de valence.
Les électrons de valence sont les électrons situés sur la couche externe.
Exemple :
1s2 2s2 2p3 : la couche externe est la numéro 2.
1s2 2s2 2p6 3s1 : la couche externe est la numéro 3.
1s2 : la couche externe est la numéro 1.
Ainsi, prenons les éléments d’une même colonne : O et S, de configuration électronique :
O : 1s2 2s2 2p4
S : 1s2 2s2 2p6 3s2 3p4
Pour O, la couche externe est la numéro 2, elle présente 6 électrons de valence (2 sur la sous-couche s et 4 sur la p).
Pour S, la couche externe est la numéro 3, elle présente 6 électrons de valence (2 sur la sous-couche s et 4 sur la p).
Ainsi, O et S ont le même nombre d’électrons de valence, donc ils sont sur la même colonne et appartiennent à la même famille chimique !
On peut aller plus loin en mettant dans le tableau uniquement la dernière sous-couche de la configuration électronique (les … remplacent ce qu’il y a avant) :
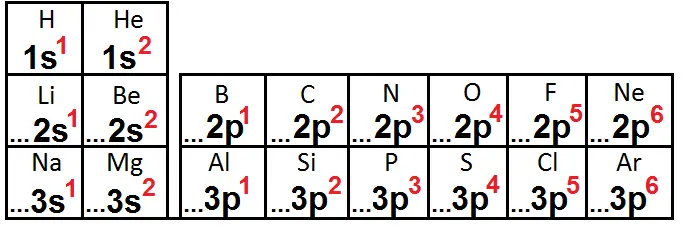
On remarque que pour les éléments d’une même colonne, la dernière sous-couche est la même et contient le même nombre d’électrons, seule le numéro de la ligne change (le numéro de la couche).
Par exemple pour N et P, leur dernière sous-couche est 2p3 et 3p3 : seul le numéro de la couche change, à savoir 2 pour N et 3 pour P, ce qui est logique car N est sur la 2ème ligne et P sur la 3ème ligne.
Bon c’est bien joli tout ça mais quel est le rapport avec les ions ??
Et bien en fait, chaque atome va chercher à devenir stable, c’est-à-dire qu’il va chercher à ce que sa configuration électronique soit celle du gaz noble le plus proche de lui.
On rappelle que les gaz nobles (ou gaz rares) sont ceux de la dernière colonne, à savoir l’hélium, le néon et l’argon (ici on va remettre l’hélium tout à droite) :
Les configurations électroniques de ces 3 gaz nobles sont :
He : 1s2
Ne : 1s2 2s2 2p6
Ar : 1s2 2s2 2p6 3s2 3p6
Les atomes vont donc chercher à avoir une de ces 3 configurations électroniques, en gagnant ou en perdant des électrons, ce qui va donner des ions.
On remarque qu’à chaque fois, la couche externe est remplie au maximum.
Pour l’hélium, c’est la 1ère couche, qui a 2 électrons : c’est la règle du duet.
Pour le néon, c’est la 2ème couche, qui a 8 électrons : c’est la règle de l’octet.
Pour l’argon, c’est la 3ème couche, qui a 8 électrons : c’est la règle de l’octet.
Cela nous amène ainsi à la partie fondamentale de ce chapitre : la règle du duet et la règle de l’octet.
Plusieurs formulations existent de ces deux règles, nous t’en proposons une (qui est à connaître par cœur en cas d’interro de cours  )
)
—
Règle du duet : un atome ou un ion est stable si la 1ère couche correspond à la couche externe et comporte deux électrons.
Règle de l’octet : un atome ou un ion est stable si la 2ème ou 3ème couche correspond à la couche externe et comporte huit électrons.
—
Bon c’est bien joli ces règles mais comment on les applique ??
En fait cela signifie qu’un atome va chercher à devenir stable c’est-à-dire à avoir une des trois configurations électroniques que l’on a données ci-dessus, en perdant ou en gagnant des électrons.
Imaginons par exemple que l’on ait un atome de Bore, dont le numéro atomique est Z = 5. Il y a 5 protons donc 5 électrons car l’atome est électriquement neutre.
Donc on a 1s2 2s2 2p1
Il a le choix entre devenir :
1s2 (en perdant 3 électrons)
1s2 2s2 2p6 (en gagnant 5 électrons)
1s2 2s2 2p6 3s2 3p6 (en gagnant 13 électrons)
Evidemment il va choisir le plus simple à savoir perdre 3 électrons (on prend le chiffre le plus petit).
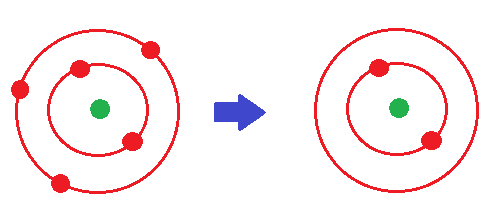
Or s’il perd 3 électrons, il n’y a plus que 2 électrons (négatifs), mais il y a toujours 5 protons (positifs) dans le noyau.
L’atome n’est donc plus électriquement neutre, mais a trois charges positives en plus, il devient 3+ : l’atome de Bore est devenu un ion !!
Comme il a 3 charges positives en plus, il se note B3+
—
L’atome a PERDU des électrons, mais comme ils sont négatifs l’ion est POSITIF.
On pourrait croire que s’il perd quelque chose il devient négatif mais non, c’est l’inverse.
En fait, comme il perd des électrons qui sont négatifs, c’est comme en maths les signes – s’annulent. C’est une manière de retenir.
Et quand l’atome gagne des électrons, il devient négatif (voir exemple ci-dessous)
—
Prenons maintenant l’exemple d’un atome qui va gagner des électrons.
Prenons l’oxygène O, de numéro atomique Z = 8. Cela donne 1s2 2s2 2p4
Il a le choix entre devenir :
1s2 (en perdant 6 électrons)
1s2 2s2 2p6 (en gagnant 2 électrons)
1s2 2s2 2p6 3s2 3p6 (en gagnant 10 électrons)
Il va évidemment devenir 1s2 2s2 2p6 et donc gagner deux électrons.
S’il gagne 2 électrons, il y aura 10 électrons (négatifs), mais il y a toujours 8 protons (positifs).
L’atome a deux charges négatives en plus, il devient 2-.
Comme il a 2 charges négatives en plus, il se note O2-
Auparavant on voyait la configuration électronique avec les couches K, L et M.
Cela n’est plus au programme mais si jamais tu en entends parler, tu pourras aller voir la vidéo sur la configuration électronique avec K, L et M.
Comme tu le vois il n’y a rien de bien compliqué si tu as compris le chapitre sur les atomes.
Retiens bien la règle du duet et de l’octet cela revient très souvent en exercice !
Mais pour devenir stable un atome peut ne pas devenir un ion mais se mettre sous forme de molécule.
C’est ce que l’on va voir dans le chapitre sur les molécules.
Les exercices sur ce chapitre sont disponibles en cliquant sur ce lien !



Très claire votre façon d’expliquer merci
Une pédagogie d’excellente facture !
bonjour.
c’est mon premier site que je visite car je débute aujourd’hui dans la physique mais il me semble que
quand vous marquez:
Et on ne passe pas à la sous-couche suivante tant que l’on n’a pas rempli la sous-couche d’avant !!
Imaginons que l’on ait 16 électrons :
on met 2 électrons sur la sous-couche 1s, donc 1s2 (il n’en reste plus que 14)
on met 2 électrons sur la sous-couche 2s, donc 2s2 (il n’en reste plus que 12)
on met 6 électrons sur la sous-couche 2p, donc 2p6 (il n’en reste plus que 6)
on met 2 électrons sur la sous-couche 3s, donc 3s2 (il n’en reste plus que 4)
on met 2 électrons sur la sous-couche 3p, donc 3p4 (il ne reste plus d’électrons)
il devrait être écrit:
on met 4 électrons sur la sous-couche 3p, donc 3p4 (il ne reste plus d’électrons)
en espérant ne pas avoir dit de bêtises
En effet l’erreur a été corrigée !
J’ai tout compris un énorme merci à vous. Je partagerai ce site à mes camarades.
Merci !
Bonjour,
Je me prépare pour passer un concours dans les prochains mois, et la partie physique chimie me rebutait vraiment jusqu’à aujourd’hui.
Merci beaucoup pour ce site, tout y est expliqué très clairement et simplement.
Formidable !