Sommaire
Introduction
Qu’est-ce-qu’un atome ?
Masse des particules
Charge des particules
Numéro atomique
Nombre de masse – notation
Isotopes
Calculs pouvant être demandés
Exemple complet
Exercices
Dans ce chapitre nous allons voir ce qu’est un atome et les différents calculs que l’on peut te demander d’effectuer dans les exercices.
Ce chapitre est très important car c’est un des chapitres de base de la chimie qui permet de comprendre d’autres chapitres par la suite. Retiens donc bien ce qui va suivre !
Un exemple complet en fin de chapitre te permettra de voir concrètement ce qui peut t’être demandé dans les exercices 
Pour décrire un atome, rien de tel qu’un bon schéma ! (que tu dois être capable de savoir refaire évidemment 
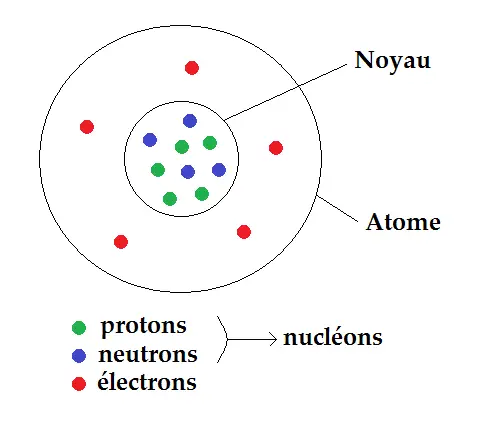
Nous allons expliquer un peu le schéma : comme tu le vois l’atome est une sphère composée de trois types de particules : les protons, les neutrons, et les électrons (leur nombre dans le schéma n’est qu’à titre d’exemple et peut varier).
Les protons et les neutrons sont au centre de l’atome et constituent ce que l’on appelle le NOYAU.
Les électrons sont autour du noyau et constituent ce que l’on appelle le CORTÈGE ELECTRONIQUE (ou nuage électronique).
Comme les protons et les neutrons sont dans le noyau, on les appelle aussi les NUCLÉONS (noyau et nucléon sont deux mots ayant la même racine).
Donc quand on parle de nucléons, on parle des protons et des neutrons sans distinction. Un nucléon peut donc être un proton ou un neutron.
Les protons, neutrons et électrons, qui sont tous les trois des particules, ont trois caractéristiques que l’on va souvent chercher à calculer dans les exercices : la MASSE, la CHARGE, et leur NOMBRE.
Concernant la masse :
La masse des protons et des neutrons est quasiment la même, environ 1,672 x 10-27kg (ce n’est pas à retenir  )
)
Remarque importante : comme la masse d’un proton et d’un neutron est presque la même, on parle souvent de masse d’un nucléon.
La masse des électrons est d’environ 9,11 x 10-31kg.
La masse des électrons est donc environ 1000 fois plus petite que celle des nucléons !!!
La masse des électrons est donc NÉGLIGEABLE par rapport à celle des nucléons.
Cela a une conséquence importante : la masse d’un atome est concentrée dans le noyau !!!
En effet, mis à part les protons, électrons et neutrons, il n’y a rien d’autre dans un atome. Et comme la masse des électrons est négligeable par rapport à celle des protons et neutrons, la masse du noyau est celle des protons et des neutrons, c’est-à-dire des nucléons !
Nous verrons que cela a une grande importance quand nous ferons des calculs.
Cependant il existe une petite particularité : on vient de voir que la masse de l’atome est concentrée dans le noyau. Mais le noyau est en réalité minuscule par rapport à l’atome !! (le schéma ci-dessus ne respecte donc pas les proportions).
C’est comme si l’atome était un stade de foot et le noyau un ballon au milieu du terrain. Sauf que le ballon est extrêmement lourd 
Pour te donner un ordre de grandeur, le rayon d’un atome est environ 10-10 m mais celui d’un noyau est d’environ 10-15 m, c’est-à-dire 100 000 fois plus petit !
L’atome est donc essentiellement composé de vide.
—
Ce qu’il faut retenir : la masse d’un proton et d’un neutron est quasiment la même. Mais un électron est environ 1000 fois plus léger : la masse des électrons est donc négligeable par rapport à celle des protons. Ainsi la masse de l’atome est concentrée dans le noyau.
Cependant, le noyau est minuscule par rapport à la taille de l’atome.
—
Concernant la charge des particules :
La charge électrique d’une particule est une grandeur caractéristique un peu comme la masse.
La charge électrique s’exprime en COULOMB, et se note C. Elle peut être négative.
Par exemple : la charge est de 3 C, -5 C, etc…
Le principe est très simple :
les neutrons, comme leur nom l’indique, sont NEUTRES, donc leur charge est de 0 C (pas trop compliqué à retenir 
Les protons sont positifs, leur charge est de 1,6 x 10-19 C (pour retenir : proton commence par un P comme Positif)
Les électrons sont négatifs, leur charge est de -1,6 x 10-19 C.
Tu remarques que protons et électrons ont la même charge au signe près : les uns sont positifs et les autres sont négatifs.
Cette valeur commune est une référence de base qui se note e et est appelée charge élémentaire.
Donc e = 1,6 x 10-19 C
La charge d’un proton est donc e, et celle d’un électron -e.
Par ailleurs, tu auras remarqué que le noyau est composé de protons et de neutrons, donc de charges positives et neutres.
Le noyau est donc électriquement…positif !!
Tandis que le cortège électronique étant composé d’électrons négatifs, il est évidemment négatif.
Mais qu’en est-il de l’atome tout entier ?
Tu dois retenir une chose importante : dans un atome, il y a autant de protons que d’électrons. Or on a vu que la charge est la même mais l’une est positive et l’autre négative, donc les charges s’annulent ! La charge d’un atome est de 0 C.
Ainsi :
—
Dans un atome, il y a autant de protons que d’électrons, donc l’atome est électriquement neutre !!
—
C’est une des choses que l’on utilisera le plus dans les exercices.
—
Ce que tu dois retenir : les neutrons sont neutres, les protons positifs et les électrons négatifs, et la charge s’exprime en Coulomb.
La charge d’un proton est e, celle d’un électron -e (e est la charge élémentaire).
Le noyau est électriquement positif, mais un atome est électriquement neutre car il y a autant de protons que d’électrons.
—
Parlons maintenant du nombre de chacune de ces particules dans l’atome.
Tout d’abord nous venons de voir qu’il y a autant de protons que d’électrons.
Ce nombre commun est noté Z et se nomme le numéro atomique.
Pourquoi numéro atomique ? Tout simplement parce que ce nombre détermine la nature de l’atome, c’est-à-dire si c’est du carbone, du fer, de l’hydrogène, de l’oxygène etc…
Ainsi, il y a une chose très importante à retenir : si Z = 6 correspond à du carbone par exemple, tu ne peux pas avoir un autre atome dont le Z vaut 6 !!
On en reparlera dans la partie en dessous.
Retiens cependant que Z correspond au nombre de protons et non au nombre d’électrons.
Mais c’est la même chose diras-tu !! 
Oui mais quand nous verrons les ions, ce ne sera pas pareil, donc retiens que Z est le nombre de PROTONS.
Ainsi, si dans les exercices tu sais que Z = 6 et que l’on te demande le nombre de protons, tu dis :
Z = 6 donc il y a 6 protons.
Et si on te demande le nombre d’électrons, tu dis :
L’atome est électriquement neutre donc il y a autant d’électrons que de protons, donc il y a 6 électrons puisqu’il y a 6 protons.
Et comment calculer le nombre de neutrons ?
Cela dépend d’un autre paramètre que l’on appelle le nombre de masse et qui se note A.
A correspond au nombre de nucléons.
Or nucléons = protons + neutrons. Pour avoir le nombre de neutrons il suffit donc d’enlever le nombre de protons, qui est Z !
Donc le nombre de neutrons est A – Z.
A noter qu’il n’y a pas de lettre spécifique pour le nombre de neutrons.
Pourquoi A s’appelle le nombre de masse ?
Tout simplement parce que l’on a vu que la masse de l’atome était concentrée dans le noyau, c’est-à-dire les nucléons. La masse d’un atome dépend donc de son nombre de nucléons, donc de A.
Ainsi, avec A et Z, on peut calculer le nombre de protons, de neutrons et d’électrons. On va alors introduire une notation qui permet de résumer cela :

Qu’est-ce-que c’est que ça ? 
Avec un exemple ce sera beaucoup mieux :

Le C au milieu est ce qu’on appelle le symbole de l’atome. Chaque atome est en effet désigné par un symbole : H pour l’hydrogène, O pour oxygène, Na pour le sodium, C pour le carbone, etc… Ils sont tous regroupés dans un tableau appelé tableau de Mendéléiev que l’on verra dans un autre chapitre.
Le 14 correspond au A, et le 6 au Z (le chiffre du haut est A, le chiffre du bas est Z).
Donc pour cet atome de carbone, A = 14 et Z = 6.
A partir de là on pourra calculer le nombre de particules comme on l’a vu précédemment.
A ce stade il est judicieux de faire un tableau récapitulatif afin que tu aies les idées claires pour la suite  (les chiffres ne sont pas à retenir)
(les chiffres ne sont pas à retenir)
| Proton | Electron | Neutron | |
|---|---|---|---|
| Masse | 1,672 x 10-27 kg | 9,11 x 10-31 kg | 1,672 x 10-27 kg |
| Charge | e = 1,6 x 10-19 C | -e = -1,6 x 10-19 C | 0 C |
| Nombre | Z | Z | A – Z |
Revenons sur ce que l’on a dit ci-dessus par rapport au numéro atomique.
On a vu que le Z était caractéristique de l’atome. Ainsi, comme Z = 6 correspond au carbone, tous les carbone auront un Z qui vaut 6. Et si Z = 6 c’est forcément un carbone, ça ne peut pas être de l’oxygène par exemple !
Par contre il n’y a aucune règle sur le A, il peut être différent pour un même atome.
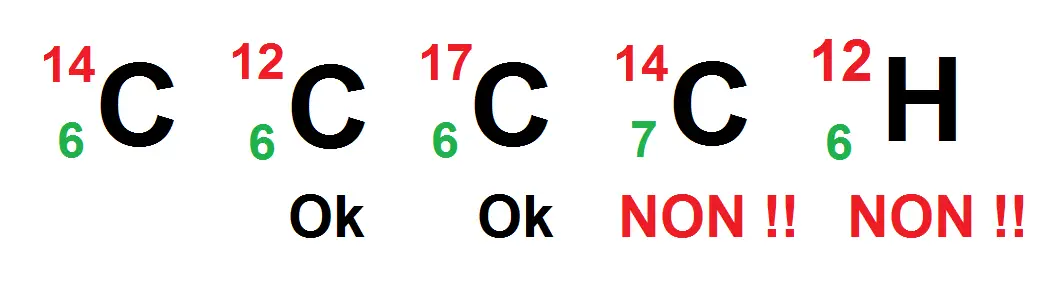
L’avant-dernier n’est pas possible car l’atome est du carbone, donc son Z vaut forcément 6, or là il vaut 7.
Le dernier n’est pas possible car le Z = 6, donc c’est forcément du carbone, or le symbole est celui de l’hydrogène.
Tu vois que le A n’intervient absolument pas dans ce type de raisonnement, il peut prendre différentes valeurs indépendamment de l’atome en question contrairement au Z.
Par contre, les trois premiers ont le même Z mais pas le même A, c’est ce qu’on appelle des isotopes.
—
Des isotopes sont des atomes qui ont le même numéro atomique mais pas le même nombre de masse (même Z mais pas même A).
—
Or s’ils ont le même Z, ils ont le même nombre de protons (et d’électrons). Mais le A (protons + neutrons) est différent, donc c’est forcément le nombre de neutrons qui est différent :
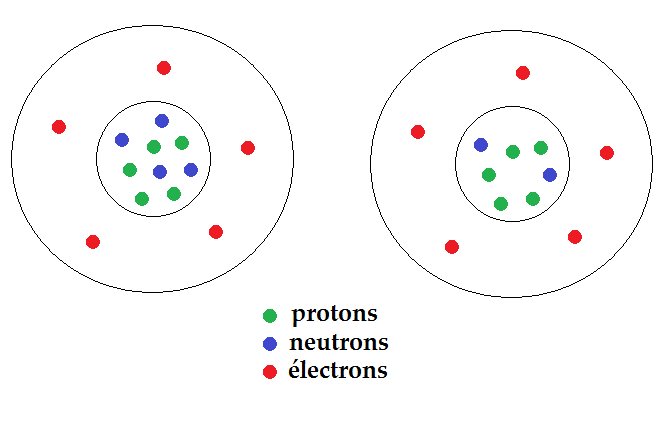
Ces deux atomes ont le même nombre de protons, le même nombre d’électrons mais un nombre de neutrons différents : ce sont des isotopes !
—
Ainsi, ce que tu dois retenir c’est que des isotopes ont le même Z mais pas le même A, mais tu dois aussi retenir que cela implique qu’ils ont un nombre de protons identiques (tout comme les électrons), mais un nombre de neutrons différents.
—
Pour information, on dit « carbone 12 » pour le carbone qui a douze nucléons, et « carbone 14 » pour le carbone qui a 14 nucléons (ce sont les deux premiers sur le schéma au-dessus avec les 5 atomes). Le carbone 14 a donc 2 neutrons de plus que le carbone 12.
Tu as peut-être déjà entendu cette expression dans « la datation au carbone 14 », car on utilise le carbone 14 pour trouver l’âge de la mort d’une matière organique.
Nous allons voir maintenant ce que concrètement tu auras comme calculs à faire dans les exercices.
1) Préambule
Tout d’abord tu dois savoir que tu auras toujours des données dans les énoncés des exercices sur ce chapitre.
—
ATTENTION !! Très souvent en physique les données sont à la FIN de l’énoncé…
—
Parmi les données que l’on peut te donner (et qu’il ne faut pas retenir), il peut y avoir :
le numéro atomique d’un atome (le Z)
le nombre de masse d’un atome (A)
la charge élémentaire (e)
la masse d’un proton qui peut être notée mp ou mproton
la masse d’un neutron qui peut être notée mn ou mneutron
la masse d’un électron qui peut être notée me ou melectron
la masse d’un nucléon qui peut être notée mn ou mnucléon
Evidemment d’autres notations peuvent être utilisées.
—
ATTENTION !! Tu auras remarqué que mn peut correspondre à la masse d’un nucléon ou d’un neutron (puisque ça commence par la même lettre) mais ils le précisent à chaque fois.
De plus, soit ils donnent la masse d’un proton et celle d’un neutron (qui est presque la même), soit ils donnent juste la masse d’un nucléon (donc proton ou neutron) sans faire la distinction.
Fais attention à bien lire l’énoncé car on verra juste après que la réponse à certaines questions dépendent de ce qu’ils mettent comme données !!
—
Généralement ils ne donnent pas la charge d’un proton ou d’un électron, qui vaut e et -e, car tu dois le savoir.
Par contre ils te donnent la valeur de e (1,6 x 10-19 C).
Remarque : dans ce qui suit, on notera mproton (sans S) la masse d’UN proton, et mprotons (avec un S) la masse de TOUS les protons contenus dans l’atome. Ainsi, pour avoir mprotons, il suffira de multiplier le nombre de protons par la masse d’un proton.
Idem pour les neutrons, électrons et nucléons.
2) Calcul de la masse du noyau
Si la question est « calculer la masse du noyau de l’atome de… », deux possibilités s’offrent à toi, tout dépend des données de l’énoncé.
a) Si dans l’énoncé on donne la masse d’un proton mproton et la masse d’un neutron mneutron :
Comme dans le noyau il y a des protons et des neutrons :
mnoyau = mprotons + mneutrons (au pluriel car c’est la masse de tous les protons et de tous les neutrons)
mnoyau = nombre de protons x mproton + nombre de neutrons x mneutron (au singulier cette fois-ci)
mnoyau = Z x mproton + (A-Z) x mneutron
Et voilà il n’y a plus qu’à remplacer avec les données de l’énoncé ! 
b) Si dans l’énoncé on donne juste la masse d’un nucléon mnucléon :
C’est plus simple car il n’y a qu’à considérer que dans le noyau il y a des nucléons sans faire la distinction entre protons et neutrons :
mnoyau = mnucléons (au pluriel)
mnoyau = nombre de nucléons x mnucléon (au singulier)
mnoyau = A x mnucléon
Et il n’y a plus qu’à remplacer !
Remarque importante : on vient de trouver deux formules différentes pour calculer la masse d’un noyau, mais sont-elles si différentes que cela (parce qu’on doit trouver le même résultat avec les deux formules normalement puisque l’on calcule la même chose).
Revenons à la première formule :
mnoyau = Z x mproton + (A-Z) x mneutron
Or on a vu qu’un proton et qu’un neutron avaient preque la même masse, donc on peut remplacer mneutron par mproton :
mnoyau = Z x mproton + (A-Z) x mproton
mnoyau = A x mproton (en développant et simplifiant)
Or un proton est un nucléon, donc on peut remplacer mproton par mnucléon, cela donne :
mnoyau = A x mnucélon
Et là, magie ! On retrouve la 2ème formule 
Il faut que tu retiennes les deux méthodes décrites précédemment car cela va dépendre de l’énoncé, ce n’est pas toi qui choisis !
2) Calcul de la masse d’un atome
Là encore la réponse va dépendre des données qui sont dans l’énoncé !
En effet, on a vu que la masse d’un atome était concentrée dans le noyau. Donc pour calculer la masse d’un atome il suffit de calculer la masse du noyau !
Sauf que parfois on te demande de tout calculer (masse du noyau + masse des électrons) et de voir que la masse est quasiment la même que celle du noyau, ce qui est une démonstration du fait que la masse des électrons est négligeable par rapport à celle du noyau.
La question qui suit est d’ailleurs généralement de comparer la masse du noyau et la masse de l’atome et d’en déduire quelque chose (il faut en déduire que la masse est concentrée dans le noyau donc la masse des électrons est négligeable par rapport à celle du noyau).
a) Si dans l’énoncé on ne donne pas la masse d’un électron :
C’est le plus simple ! Il suffit de dire : « la masse des électrons est négligeable par rapport à celle des nucléons donc la masse de l’atome est la même que celle du noyau » :
matome = mnoyau
Et il n’y a plus qu’à calculer la masse du noyau comme on l’a vu juste avant.
b) Si dans l’énoncé on donne la masse d’un électron :
A ce moment-là on fait comme précédemment avec le noyau. L’atome est composé du noyau et des électrons, donc :
matome = mnoyau + mélectrons
matome = mnoyau + Z x mélectron (on aura justifié auparavant qu’il y a Z électrons dans l’atome)
Il n’y a plus qu’à remplacer, sachant que pour la masse du noyau on utilise une des 2 méthodes décrites précédemment.
3) Calcul de la charge du noyau
Pour calculer la charge du noyau c’est très simple.
Le noyau est composé de neutrons et de protons. Mais les neutrons sont neutres donc leur charge est de 0 C. La charge du noyau ne dépend donc que des protons. La charge est souvent notée q.
qnoyau = qprotons (au pluriel)
qnoyau = nombre de protons x qproton (au singulier)
qnoyau = Z x e
Et on remplace !
4) Calcul de la charge du cortège électronique
Il est possible (c’est plus rare) que l’on te demande de calculer la charge du cortège électronique. Cela revient à calculer la charge des électrons. Le principe est exactement le même :
qcortège = qélectrons (au pluriel)
qcortège = nombre d’électrons x qélectron (au singulier)
qcortège = Z x (-e)
qcortège = – Z x e
5) Calcul de la charge de l’atome
Là il n’y a rien de plus simple !! Il suffit de dire « l’atome est électriquement neutre donc la charge de l’atome est 0 C ».
Et voilà !
Il arrive cependant que l’on te demande de le démontrer par un calcul, mais tu vas voir ce n’est pas trop compliqué^^
Comme dans l’atome il y a des protons, des électrons et des neutrons :
qatome = qprotons + qélectrons + qneutrons
qatome = Z x e – Z x e + 0 (d’après ce qui précède)
qatome = 0 C.
On retrouve évidemment la même chose.
—
Attention à ne pas confondre la charge de l’atome et la charge du noyau, c’est une erreur fréquente !!
Il faut donc bien lire l’énoncé et ne pas aller trop vite.
—
Nous allons maintenant te donner un exemple complet d’exercice dont le niveau est intermédiaire mais contient de nombreuses questions que l’on peut te poser. Il en existe des bien plus compliqués, mais si tu sais déjà faire celui-là ce sera un très bon début !
Énonce : on donne l’atome suivant :
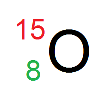
1) Donner la composition de l’atome d’oxygène.
2) Donner la composition du noyau de cet atome.
3) Quelle est la charge de l’atome ?
4) Quelle est la charge du noyau ?
5) Quelle est la masse du noyau ?
6) En déduire celle de l’atome.
Données : mnucléon = 1,67 x 10-27kg
e = 1,6 x 10-19 C
A toi de jouer !
Correction :
1) Tout d’abord, on va analyser l’énoncé :
La notation de l’atome d’oxygène nous apprend que pour cet atome, Z = 8 et A = 15.
On remarque aussi que les autres données de l’énoncé sont à la fin de l’exercice.
On va maintenant pouvoir répondre à la première question.
L’atome d’oxygène est composé de protons, de neutrons et d’électrons.
Z = 8 donc il y a 8 protons.
A – Z = 15 -8 = 7 donc il y a 7 neutrons.
De plus l’atome est électriquement neutre donc il y a autant d’électrons que de protons donc il y a 8 électrons.
L’atome d’oxygène est donc composé de 8 protons, 7 neutrons et 8 électrons.
2) Dans le noyau il n’y a que les protons et les neutrons.
Donc le noyau d’oxygène est composé de 8 protons et 7 neutrons.
3) L’atome est électriquement neutre donc sa charge est de 0 C.
4) Le noyau est composé de neutrons dont la charge est nulle, et de protons chargés positivement.
Donc qnoyau = qprotons
qnoyau = nombre de protons x qproton
qnoyau = Z x e
qnoyau = 8 x 1,6 x 10-19
qnoyau = 1,3 x 10-18 C (attention aux chiffres significatifs !!!)
5) Pour la masse du noyau, on voit dans les données qu’il n’y a que la masse d’un nucléon. Donc d’après ce que l’on a vu dans la partie consacrée à la masse :
mnoyau = mnucléons
mnoyau = nombre de nucléons x mnucléon
mnoyau = A x mnucléons
mnoyau = 15 x 1,67 x 10-27
mnoyau = 2,51 x 10-26 kg (attention aux chiffres significatifs !!!)
6) Dans les données la masse des électrons n’apparaît pas. Donc, toujours d’après ce que l’on a vu dans la partie sur la masse :
la masse des électrons étant négligeable devant celle des nucléons, la masse de l’atome est (quasiment) la même que celle du noyau :
matome = mnoyau
matome = 2,51 x 10-26 kg
Et voilà c’est terminé !
Comme tu le vois ce n’est pas sorcier, il suffit de s’entraîner un peu 
Tu peux désormais passer au chapitre suivant consacré aux ions !
Les exercices sur ce chapitre sont disponibles en cliquant sur ce lien !



Je trouve vos cours extrêmement bien organisés et expliqués. Je m’intéresse au dioxyde de chlore, formule ClO2, comme méthode de soin, et cet intérêt m’a poussé à vouloir mieux comprendre les bases de la chimie, l’oxydation-réduction… les charges, le PH, acides et bases…
Je vous remercie de rendre toutes ces connaissances accessibles.
Merci beaucoup et bon courage ! 🙂
Très bon cours, compréhensible et précis 🙂
Moi qui pensais être une brêle, j’ai suivi toutes les étapes, les explications et j’ai réussi l’exercice !!
Merci beaucoup pour votre pédagogie très efficace
Bonjour,
72 ans mais toujours curieux, je suis tombé sur votre site que je trouve très intéressant.
Une question sur un point que je ne comprend pas :
Dans le chapitre « nombre de masse-notation » vous parlez de « nombre de nucléons ».
Il semble que cela correspond au nombre de particules élémentaires de l’atome.
Qu’est-ce que je ne comprend pas ?
Merci.
Bonjour,
Merci pour cet article qui illustre le fait que « Ce que l’on conçoit bien s’énonce clairement,
et les mots pour le dire arrivent aisément » (Nicolas Boileau 1636-1711).
Remarque orthographique :
Au lieu de « Mais quand est-il de l’atome tout entier ? », j’aurais écrit « Mais qu’en est-il de l’atome … ? ».
Cordialement.
PRD
Merci ! Erreur corrigée 🙂
Top ! Merci pour votre cours. J’avais jamais été trés loin en physique et sur la notation des atomes.
Là j arrive enfin a decrypter les A et Z et le tableau. MErci
Super bien expliqué merci !!!!
Cours parfaitement expliquer, tu simplifie un cours pas forcément compris, c’est parfait
bon, je suis d’accord avec toi Léonard, c’est bien expliqué.Maintenant, il faudrait que tu te mettes à l’orthographe et à la grammaire!!
Un cours clair et précis.
Merci à vous🙏
Madame ou M. le Professeur.
J’ai 74 ans.
J’avais passé un baccalauréat Sciences Expérimentales en 1964. Le programme de l’époque en chimie m’a beaucoup frustré car j’avais de nombreuses lacunes de compréhension que les moyens de l’époque ne permettaient pas facilement de combler.
Par exemple les règles du doublet ou de l’octet n’étaient pas au programme ; on parlait tout au plus de la valence mais je n’y comprenais rien. De ce fait, il y avait un fossé entre le programme des lycées et l’enseignement supérieur.
Je souhaite combler ces lacunes, totalement rédhibitoires afin d’être en mesure de comprendre sans difficultés les articles ou ouvrages de biologie et de physiologie qui m’intéressent et qui s’appuient évidemment sur les bases enseignées ici.
Grand merci pour ce que vous faites, c’est formidable.
Merci beaucoup et bon courage pour la suite ! 🙂
excellent cours qui me permette de passer mon brevet les doigts dans le nez je vous félicite
Moi qui pensais être une brêle, j’ai suivi toutes les étapes, les explications et j’ai réussi l’exercice !!
Merci beaucoup pour votre pédagogie !
Curieux qui cherche simplement à comprendre et à s instruire
Merci
Merci !
Merci beaucoup vous me sauvez la vie ! Je suis en première année de médecine et je trouve enfin des cours adaptés à ma méthode d’apprentissage
Merci à toi et bon courage !
merci beaucoup. félicitations pour l’excellence de votre pédagogie.
Merci ! 🙂
Merci bcq
Merci beaucoup ! Je n’ai que douze ans et je regarde par curiosité mais avec vous c’est un plaisir! De plus, les explications sont très claires et je comprends très bien!
Bac D en 87… si tous les cours de chimie avaient été comme le vôtre…quel bonheur ! grâce à vous, ma fille va aimer les sciences !! Merci beaucoup !!
Merci beaucoup !!
J’ai eu mon bac s en 1993 ,j avais aucun mal à comprendre ce résumé. Merci à vous
J’étais perdue mais je me suis retrouvée merci pour le cours
Bonjour, je suis en reprise d’études d’orthophonie à la fac de médecine, j’avais fait une Tle ES il y a plus de 15 ans. J’avais une phobie de la physique chimie dans mon souvenir… et là grâce à vous tout est plus clair et bcp plus accessible !! merci bcp !!
Merci beaucoup et bon courage !!
je ne saurais vous remercier, la meilheur explication et methode jai appris plus de cette en 10mn qu’en trois ans de cours merci pour tout
Merci beaucoup !! 🙂
Très bien détaillé
tres clair et tres precis
merci encore
Merciiiii c’est excellent je comprends mieux maintenant les calculs
Très bon cours !!!!
Merci !
Très bon cours, compréhensible et précis 👍
Merci beaucoup !