Sommaire
Introduction
Électrons de valence
Formule semi-développée
Molécules ioniques
Conclusion
Dans les chapitres précédents nous avons parlé des atomes, puis des ions. Nous allons maintenant parler des molécules.
Une molécule est un assemblage de plusieurs atomes, par exemple H2O : cela signifie qu’il y a 2 atomes de H et 1 atome de O.
Dans C4H8, il y a 4 atomes de C et 8 atomes de H.
Le 4 et le 8 sont appelés indices.
On peut également avoir des indices après une parenthèse : Cu(OH)2
Cela signifie qu’il y a 1 Cu et 2 OH, donc 2 O et 2 H.
On peut aussi avoir un chiffre devant et un indice : 3 H2.
Il y a 3 x 2 = 6 H.
Un peu plus dur : Cu(NO3)2
Ici le 3 n’est que pour le O mais le 2 est pour le NO3 (à cause de la parenthèse).
Donc il y a 1 Cu, et 2 NO3 (nitrate), donc 2 N et 6 O.
C’est un peu comme en maths avec les parenthèses !
Après cette petite introduction plutôt simple, passons aux choses sérieuses 
Nous allons rentrer un peu plus prêt au niveau de la molécule.
Nous avons vu dans le chapitre sur les ions la configuration électronique.
Par exemple pour l’atome S, Z = 16, donc (K)2(L)8(M)6
Ce que l’on appelle électrons de valence, ce sont les électrons situés sur la dernière couche, ici M. Comme on a (M)6, il y a 6 électrons de valence, et M est appelée couche de valence.
Si on a (K)2(L)5 par exemple, la couche de valence est L et il y a 5 électrons de valence.
On va disposer ces électrons de valence tout autour de l’atome en les représentant par des points.
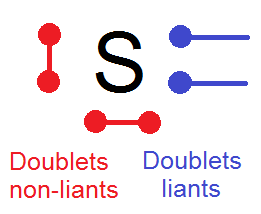
Par exemple pour S qui a 6 électrons de valence :

On va distinguer deux types d’électrons de valence.
D’après le chapitre sur les ions, S va chercher a acquérir deux électrons pour respecter la règle de l’octet. Pour cela il va mettre en commun 2 électrons de valence avec un autre atome et faire des doublets liants, que l’on appelle aussi liaison covalente.
Les électrons qui restent vont se regrouper entre eux 2 par 2 en formant des doublets non liants :
La position des doublets n’a pas d’importance on peut les mettre comme ceci par exemple :
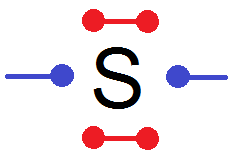
Comme tu le vois un doublet non liant relie deux électrons de valence de l’atome.
Mais un doublet liant relie un électron de valence à… pour l’instant rien du tout !
En fait le doublet liant va relier deux électrons de valence de deux atomes différents.
Il faut donc introduire un deuxième atome.
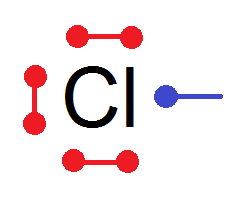
Prenons par un l’atome de chlore : Z = 17, ce qui donne (K)2(L)8(M)7
Donc 7 électrons de valence, donc d’après la règle de l’octet il va chercher à acquérir 1 électron.
Donc Cl a 7 électron de valence dont 1 qui va faire un doublet liant :
Considérons maintenant la molécule SCl2 : il y a 1 S et 2 Cl :
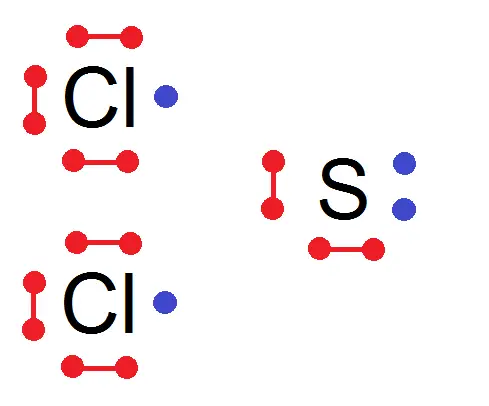
Volontairement on n’a pas mis les doublets liants mais seulement leurs électrons de valence.
En effet, le but va être maintenant de relier les électrons qui vont faire des doublets liants. Evidemment il faut relier les électrons d’un atome avec ceux d’un autre atome.
Si on relie les deux électrons de Cl entre eux, les électrons de S ne pourront pas se relier à d’autres atomes.
Donc nécessairement les électrons de Cl vont se relier avec ceux de S selon le schéma suivant :
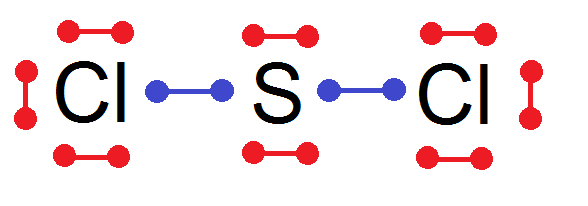
Et voilà, c’est fini !
En réalité pour simplifier on ne fait que les traits, on ne fait pas les points, ce qui donne :
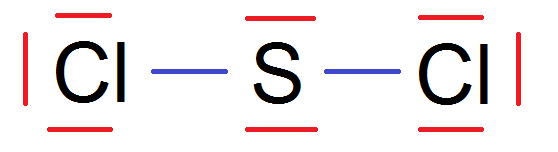
C’est ce que l’on appelle la représentation de Lewis.
Il existe une représentation de Lewis simplifiée où on ne met pas les doublets non liants, et que l’on appelle la formule développée :
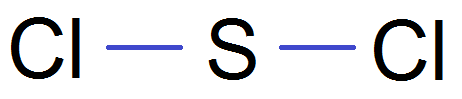
Au final, écrire la formule développée revient à mettre les liaisons entre les atomes. Pour cela il faut connaître combien de liaisons chaque atome va faire, et pour cela connaître sa configuration électronique.
Pour la formule de Lewis il suffit de rajouter les doublets non liants.
Cependant, au lycée, ce sont presque toujours les mêmes atomes qui reviennent et que l’on va étudier juste après.
Ainsi tu n’auras pas à faire la configuration électronique à chaque fois.
Les atomes que tu étudieras le plus sont C, O et H.
Le Z du carbone est 6, celui de O est 8 et celui de H est 1, leurs configurations électroniques sont donc :
(K)2(L)4, (K)2(L)6 et (K)1, d’où :
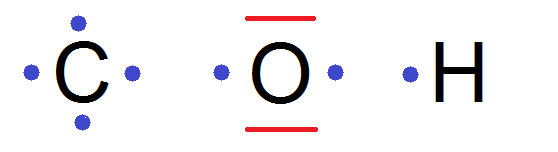
Ainsi C va faire 4 liaisons, O va en faire 2 et H 1 seule.
Du coup les H se mettront toujours à la fin, pour « combler les trous » une fois que les autres atomes auront été mis.
Exemple : on cherche la formule développée de C3H8
On va mettre d’abord les C, et ensuite les H :
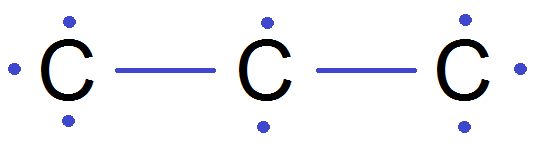
Et on complète avec les H :
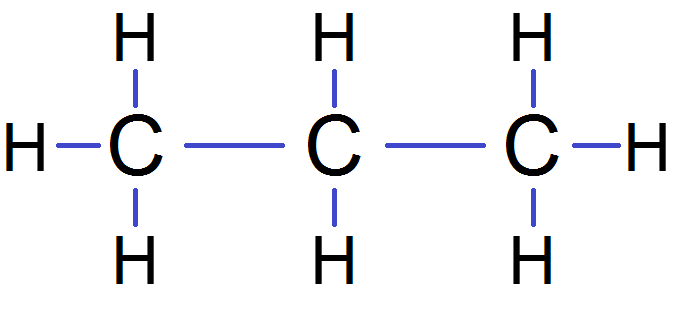
Tu auras très souvent ce genre de molécules avec des C et des H, et éventuellement des O.
Exemple : C2H6O
Comme on fait les H en dernier, on fait d’abord les C et le O :
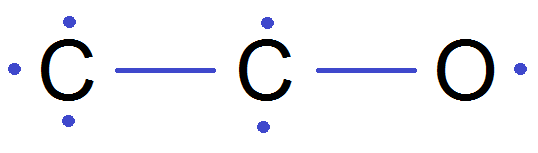
Puis on complète avec les H :
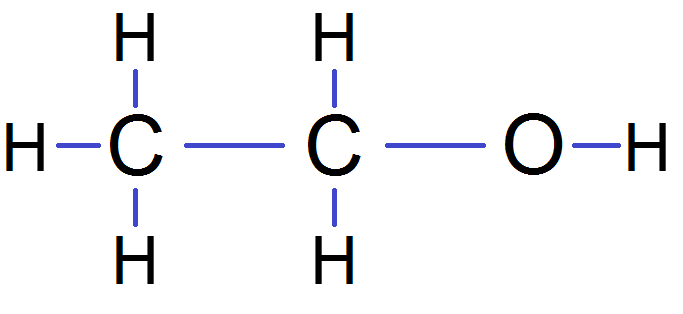
Pour simplifier encore plus, il existe une autre représentation : la formule semi-développée.
C’est pareil que la formule développée mais il n’y a pas les liaisons H : on met avec chaque atome le nombre de liaisons H qu’il fait.
Ainsi :

devient
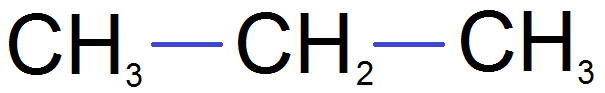
Et

devient
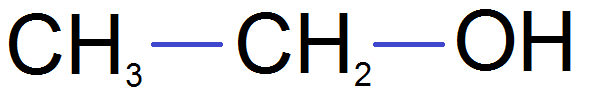
Comme tu le vois ce n’est pas compliqué ! 
Depuis le début toutes les molécules sont neutres, il n’y a pas de charge + ou -.
Mais certains peuvent être comme des ions et comporter des charges : ce sont des molécules ioniques.
Pour expliquer cela, prenons l’exemple ci-dessus mais avec la formule de Lewis :
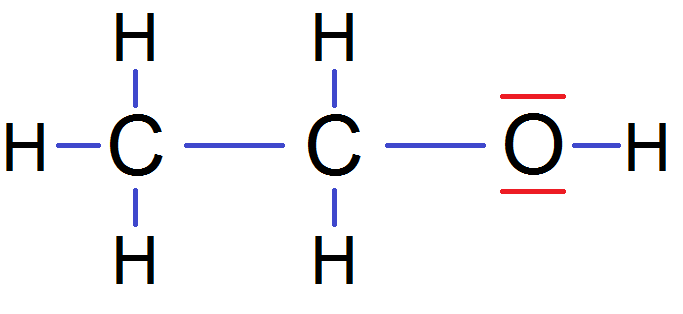
Considérons le C tout à gauche : pour respecter la règle de l’octet, il devrait avoir 8 électrons sur sa couche externe.
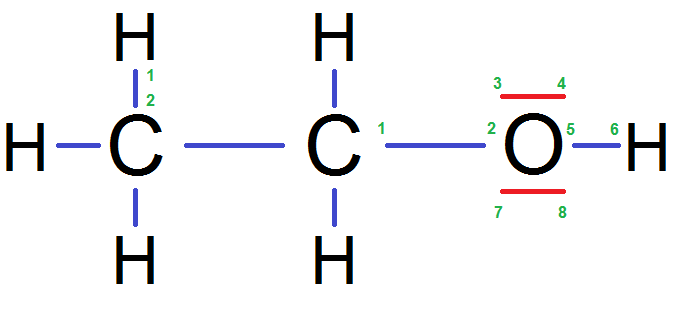
En fait dans une molécule, les électrons de la couche externe sont ceux des doublets non liants, et ceux des doublets liants. Numérotons ceux de cet atome C :
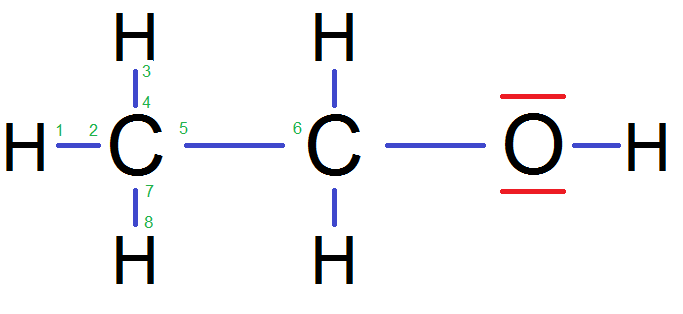
Il y en a bien 8, le compte est bon ! Tu remarqueras que l’on compte les électrons des H et de l’autre C car il y a un doublet liant.
En fait les atomes « partagent » leurs électrons avec les autres atomes.
Il en va de même pour le O et le H (sauf que le H n’en a que 2 car il respecte la règle du duet) :
Sachant cela, considérons la molécule NO2– (nitrite).
D’où vient le signe – ??
Pour cela il faut écrire la formule de Lewis des atomes (le Z du N vaut 7) :
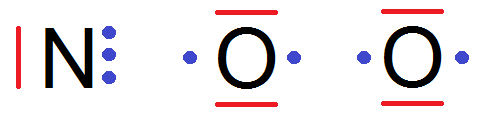
Cela va donner :
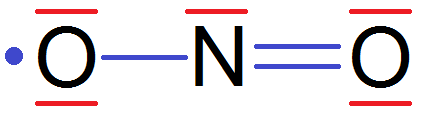
Et là tu remarques qu’il y a un électron tout seul sur le O de gauche parce qu’il n’y a plus d’électrons avec qui il peut se mettre !
Donc on va rajouter un électron qui vient d’ailleurs pour le mettre avec lui. Sauf qu’il va former un doublet non liant car il ne sera pas relié à un atome :
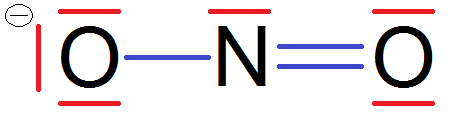
Et là tu te demandes pourquoi il y a un signe – entouré à côté du O.
Tout simplement parce qu’on a rajouté un électron, donc une charge négative, donc il devient -, c’est comme les ions !
Cela explique pourquoi on écrit NO2–
—
ATTENTION ! Quand on écrit NO2–, le – n’est qu’une seule fois, c’est comme si on écrivait (NO2)–. L’indice des atomes n’influence absolument pas le nombre de charges.
De plus, le fait d’écrire NO2– ne signifie pas que la charge – est forcément sur O, elle aurait pu être sur le N.
—
Comme tu le vois il y a plusieurs manières de représenter les molécules (et encore il y en a d’autres!). Comme d’habitude, seul l’entraînement te permettra de bien comprendre et d’être efficace.
Tu auras remarqué que dans l’exemple juste avant le N faisait 2 liaisons avec le O de droite : c’est ce que l’on appelle une liaison double. Il existe même des liaisons triples !
Par ailleurs, quand on relie les atomes entre eux en faisant des doublets liants, il existe parfois plusieurs moyens de relier les atomes entre eux. C’est ce qu’on appelle des isomères.
Mais comme le chapitre était déjà assez long nous avons décidé de faire un autre chapitre qui parlera de cela.



Bonjour,
Merci beaucoup pour ces explications très claires.
Merci à toi !
Enfin un cours clair…..félicitation
Toujours très clair, court et facile à comprendre, super !
Merci 😊
Bonsoir et il serait parfait de pouvoir télécharger vos magnifiques cours.
Un admirateur