Sommaire
Introduction
Les isomères
Identifier les non-isomères
Trouver les isomères d’une molécule
Isomères de chaîne, de position et de fonction
Exercices
Nous allons parler dans ce chapitre des isomères de constitution, notion vue en Première au lycée, à ne pas confondre avec les isomères de conformation ou de configuration qui seront étudiés en Terminale, et qui font l’objet d’un chapitre distinct (qui sera bientôt disponible  )
)
Les isomères de constitution peuvent se décomposer en isomères de chaîne, de position et de fonction mais ce n’est pas au programme au lycée, nous en parlerons rapidement à la fin du chapitre pour que tu comprennes ce que c’est.
Pour bien comprendre certaines parties il faut absolument maîtriser le cours sur la nomenclature des molécules. Si ce n’est pas le cas tu es invité à lire (ou relire) ce cours 
Rentrons tout de suite dans le vif du sujet avec la définition d’isomères :
—
Des isomères sont des molécules ayant la même formule brute mais des formules semi-développées différentes.
—
Retiens bien cette définition par cœur elle est souvent demandée en question de cours !
Voyons tout de suite un exemple avant de commenter cette définition.
Prenons la molécule C4H10 :
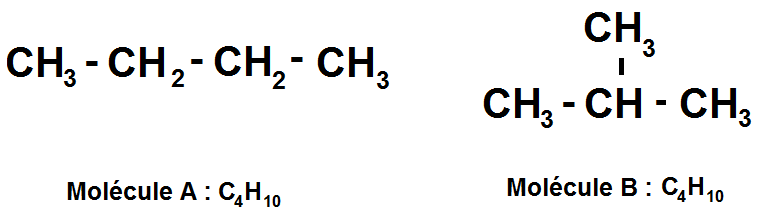
Les deux molécules A et B ont la même formule brute (C4H10) mais pas la même formule semi-développée : les molécules A et B sont isomères !
Plusieurs remarques concernant la définition des isomères :
– dire qu’une molécule est isomère, ça ne veut rien dire ! L’isomérie concerne au moins deux molécules. On peut dire en revanche qu’une molécule est isomère d’une autre molécule, ou encore mieux que deux molécules sont isomères. On peut aussi dire que telle molécule est un des isomères de telle formule brute.
– la formule semi-développée suffit, pas besoin de faire la formule développée. Au passage tu notera que semi ne s’accorde pas, on n’écrit pas semie-développée mais semi-développée, c’est mieux s’il n’y a pas de faute d’orthographe sur ta copie 
Rien ne t’empêche cependant de faire la formule développée.
– une molécule peut posséder plusieurs isomères (nous verrons cela en détails après).
Bon c’est bien joli tout ça mais à quoi servent des isomères ?
Il faut savoir que des molécules isomères ont des propriétés physiques et chimiques différentes.
Par exemple, les molécules A et B de l’exemple ci-dessus peuvent avoir des températures d’ébullition différentes, des densités différentes, des réactivités chimiques différentes etc…
Tu n’as pas à apprendre tout cela par coeur, retiens juste que des molécules isomères ont des propriétés physiques et chimiques différentes.
Ce que tu dois également savoir, c’est trouver les différents isomères à partir d’une même formule brute.
Mais avant cela, il faut savoir identifier les molécules qui ne sont PAS isomères, c’est ce que nous allons voir tout de suite.
Dans certains exercices, tu auras différentes molécules sous forme semi-développée et tu devras identifier celles qui sont isomères.
Pour cela, il faut savoir identifier celles qui ne le sont pas !
Tout d’abord, le plus simple est de regarder si les deux molécules ont la même formule brute ou pas.
Si ce n’est pas le cas, elles ne sont pas isomères !
Exemple :
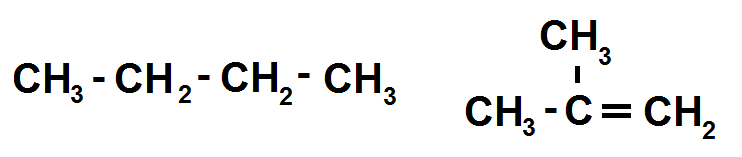
La molécule de gauche a pour formule brute C4H10 alors que la molécule de droite a pour formule brute C4H8, ce n’est pas la même chose !
Donc ces deux molécules ne sont pas isomères.
L’autre cas où les molécules ne sont pas isomères, c’est quand elles sont… identiques !
En effet, par symétrie, certains molécules apparemment isomères sont en fait symétriques.
Exemple :
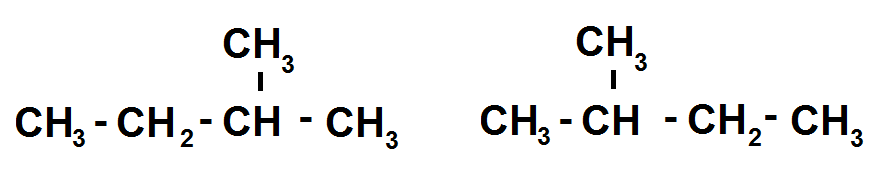
Ces deux molécules ont même formule brute (C5H12) et ont apparemment une forme semi-développée différente alors qu’en réalité elle sont identiques.
En effet, on a une chaîne principale constituée de 4 carbones, et une ramification constituée d’un carbone portée par le carbone numéro 2 :
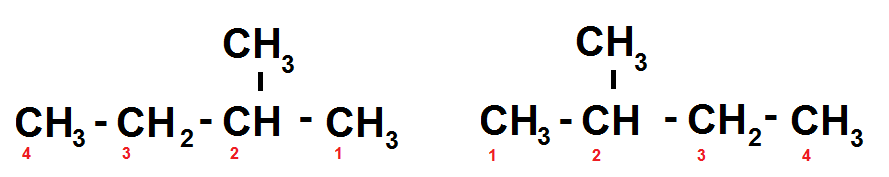
les chiffres en rouge correspondent au numéro du carbone
On rappelle en effet que les carbones sont numérotés de manière à ce que les ramifications soient sur les carbones de plus petit numéro (c’est ici que tu comprends qu’il faut bien connaître son cours sur la nomenclature  )
)
On peut également avoir ce genre d’exemples :
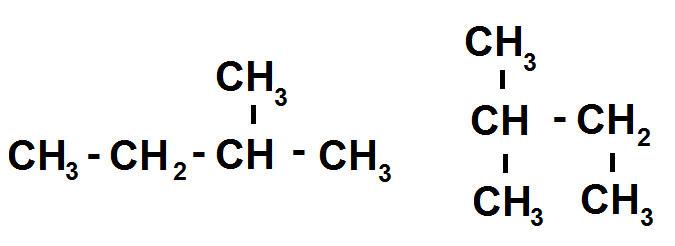
Les CH3 aux extrémités de la chaîne principale ont simplement été écrits en-dessous et non sur les côtés mais cela ne change rien, ces deux molécules sont identiques.
Nous verrons d’autres exemples dans les exercices, avec notamment des atomes autres que du carbone et de l’hydrogène.
L’exercice classique sur les isomères est de te donner une formule brute, puis de te demander de trouver les différents isomères correspondants à cette formule brute.
Pour cela 2 possibilités :
– si la formule brute est simple (peu d’atomes), on peut faire par tâtonnement et deviner quelles seront les différents isomères : c’est simple mais tu risques d’en oublier certains…
– dans tous les cas, on peut faire de manière un peu plus méthodique, ce qui évitera les erreurs, mais ce sera peut-être un peu plus long (et encore, ce n’est pas sûr…  )
)
Tu l’auras compris, le mieux est de le faire méthodiquement avec la méthode que l’on va te proposer.
1) Ecrire une première molécule la plus simple possible
On va commencer par écrire une des formules semi-développées la plus simple possible.
Pour cela, on va prendre tous les atomes qui ne sont pas des hydrogènes H.
En effet, ces H ne font qu’une seule liaison, ils sont là pour « boucher les trous » et faire en sorte que chaque atome fasse le bon nombre de liaisons, mais ce n’est pas eux qui permettront de faire des isomères.
Les H s’écrivent donc toujours à la fin. C’est d’ailleurs la raison pour laquelle on écrit la formule semi-développée et non la formule développée.
Ainsi, on prend tous les autres atomes et on fait la chaîne la plus simple possible, c’est-à-dire une chaîne sans ramification !
Par exemple : C4H9O2Cl
Ici il y a du 4 C, 2 O et 1 Cl (mis à part les H).
On fait donc une chaîne avec tous ces atomes les uns à la suite des autres :
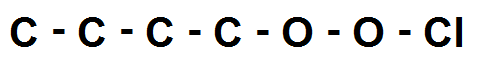
On ne peut pas faire plus simple !
—
Remarque : les halogènes (F, Cl, Br, I) ne font qu’une seule liaison, ils sont donc nécessairement en bout de chaîne pour cette première étape.
—
Ensuite il suffit de rajouter les H pour que chaque atome fasse le bon nombre de liaisons.
On rappelle que C fait 4 liaisons, et O en fait 2 (ce sont les atomes que tu rencontreras le plus).
Et voilà on a fait notre premier isomère !
Comme tu le vois c’est très simple 
Cette première étape est cruciale car elle permet de savoir s’il y a des liaisons doubles ou pas !
En effet, en rajoutant les 9 H de la formule brute, on voit que chaque atome fait le bon nombre de liaisons, donc pas besoin de liaisons doubles.
Si en revanche il manquait des H, cela voudrait dire qu’il manque une (ou plusieurs) liaisons doubles.
Cela est important car on a la propriété suivante :
—
Si une molécule n’a pas de liaison double, les autres isomères n’auront pas de liaison double non plus.
Si une molécule possède une ou plusieurs liaisons doubles, les isomères auront autant de liaisons doubles.
ATTENTION : 2 liaisons doubles peuvent être remplacés par une liaison triple…
—
Exemples :
Prenons la molécule de formule brute C4H8
On met d’abord la chaîne principale sans ramification :
On rajoute ensuite les 8 H :
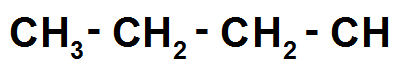
Et là on remarque qu’il manque 2 liaisons au C tout à droite !
Il faut donc faire une liaison double :
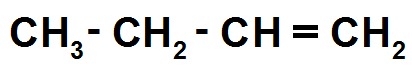
Les isomères de C4H8 posséderont donc tous une liaison double.
2) Trouver les autres chaînes principales
Cette 2ème étape va consister à identifier les différentes chaînes principales possibles avec leurs ramifications, que l’on peut appeler le squelette de la molécule.
Pour cela on ne va prendre en compte que les atomes faisant au moins 2 liaisons : on ne prend donc en compte ni les H ni les halogènes (F, Cl Br, I) qui ne font qu’une seule liaison.
Ici pas de formule magique mais quelques principes à appliquer :
– penses à faire des chaînes de longueur principale différente avec des ramifications
– s’il n’y a pas que des carbones, penses à mélanger l’ordre d’enchaînement des atomes
(C – C – O et C – O – C par exemple)
– penses à changer de place la position de la ou des liaisons doubles s’il y en a : un même enchaînement d’atome mais avec une liaison double placée différemment donnera deux molécules différentes
– attention aux symétries ! On croit parfois avoir trouvé des molécules différentes alors que ce n’est pas le cas (on en a déjà parlé précédemment).
Prenons par exemple C4H10O : si on fait la première étape, on verrait qu’il n’y a pas de liaison double.
La chaîne principale la plus simple est : C – C – C – C – O.
Faisons d’abord varier la position de O dans cette chaîne :
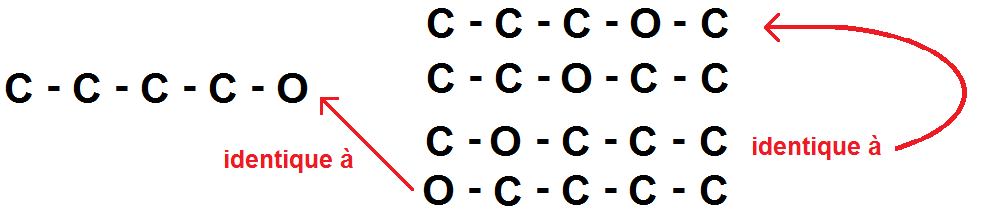
On trouve deux autres squelettes possibles (il y en a deux autres mais qui sont identiques par symétrie).
On peut faire ensuite une chaîne avec des ramifications :
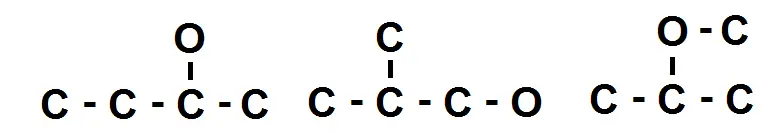
Ici on trouve 3 nouveaux squelettes, ce qui donne 5 isomères (en plus de la molécule initiale).
Par contre impossible de savoir si on en a pas oublié, il faut donc faire très attention…
3) On rajoute les autres atomes (sauf les H)
A la troisième étape, on va rajouter les atomes ne formant qu’une seule liaison (sauf les H), c’est-à-dire les halogènes (F, Cl, Br, I).
Ces atomes peuvent aller sur chacun des atomes des chaînes trouvées à l’étape 2 qui n’ont pas leur nombre total de liaisons.
Prenons un exemple simple : C2H5OCl
A l’étape 2 on aurait trouvé deux chaînes : C – C – O et C – O – C.
Dans C – C – O, les 2 C et le O peuvent encore faire des liaisons, donc on peut mettre le Cl sur chacun de ces atomes :
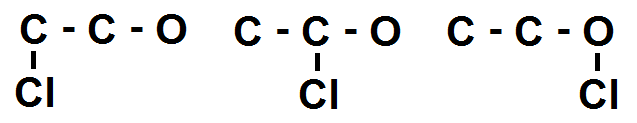
On vérifie qu’aucune de ces molécules n’est identique.
Pour C – O – C en revanche, le O fait déjà 2 liaisons, donc le Cl ne peut pas se lier à lui, seuls les 2 C le peuvent :
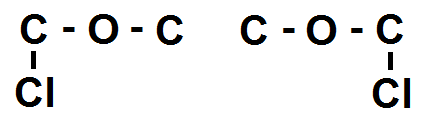
Mais là on remarque que les deux molécules sont identiques ! On ne prend donc que la molécule de gauche.
4) Rajouter les H
Cette dernière étape est très simple donc nous ne détaillerons pas trop, il s’agit de rajouter les H restants pour que chaque atome fasse le bon nombre de liaisons : si tu ne t’es pas trompé aux étapes précédentes cela ne devrait poser aucun problème.
Si en revanche il y a un souci (par exemple il y a trop ou pas assez de H dans la formule brute), cela signifie que tu as fait une erreur quelque part : cette étape est donc un bon moyen de vérifier que tu ne t’es pas trompé.
Cette 4ème étape ne va pas rajouter d’isomères, ce seront les mêmes qu’à la troisième étape (mais avec des H en plus).
5) Vérifier qu’il n’y a pas de doublon
Cette dernière étape pourrait sembler superflue car à chaque étape précédente on a vérifié que l’on avait pas de doublon.
Oui, mais on ne sait jamais… 
Regardes donc bien tous les molécules trouvées et demande-toi si certaines ne sont pas identiques par symétrie pour éventuellement les enlever.
Nous verrons bien sûr beaucoup d’exemples en exercices, car pour ce chapitre l’entraînement compte beaucoup !
Avant de passer aux exercices, nous allons parler des isomères de chaîne, de position et de fonction comme précisé dans l’introduction.
Les isomères que l’on a vu précédemment peuvent en effet se classer en 3 catégories :
– isomères de squelette ou de chaîne : les atomes de carbone des isomères ne sont pas disposés de la même manière (on ne s’intéresse qu’aux atomes de carbone).
– isomères de position : un groupe caractéristique n’est pas positionné au même endroit.
– isomères de fonction : les fonctions des deux molécules sont différentes.
Exemples :
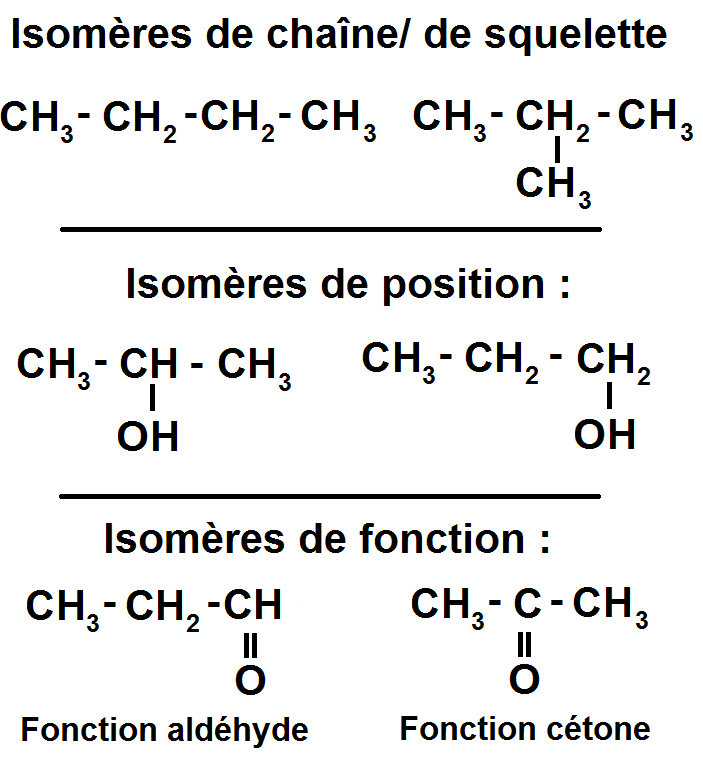
Au lycée tu n’as pas à connaître tout cela mais rien ne t’empêche de l’apprendre évidemment.
Passons maintenant aux exercices !
Les exercices sur les isomères sont disponibles en cliquant sur ce lien !
Retour au sommaireHaut de la page



Aucun doute, le meilleur site pour expliquer la chimie au lycée ! Toujours l’impression que le concept compliqué devient simple ! Encore bravo !!
Bonjour,j’aime
Bonjour.
merci pour la qualité de vos cours. ils sont vraiment très intéressant.
Juste un détail: en début de ce cours il est recommandé de lire le chapitre sur la nomenclature des molécules avant. Et dans le cours sur la nomenclature c’est le contraire. Il y a un point similaire avec le cours sur la table des éléments.
ça n’enlève rien à la qualité du contenu.
Bonjour M.
Vos cours sont très intéressants. Quand mettrez vous en ligne le cours sur les isomères svp.
Merci d’avance
Merci ! Cet été normalement.