Sommaire
Introduction
Principe général
Sens des électrons et intensité
Le pont salin
Ampèremètre et courant
Équation de fonctionnement et calculs
Récapitulatif
Exercices
Une pile Daniell (du nom de son inventeur John Daniell) est, comme son nom l’indique, une pile, c’est-à-dire qu’elle va générer de l’électricité. Cela va se faire à partir d’équations chimiques.
Ce chapitre s’inscrit dans la continuité du chapitre sur l’oxydo-réduction que tu dois donc avoir vu avant. En effet, les piles Daniell font intervenir des équations d’oxydo-réduction, ce pourquoi il faut bien maîtriser ce chapitre 
Une pile Daniell est constituée de deux demi-piles selon le schéma suivant :
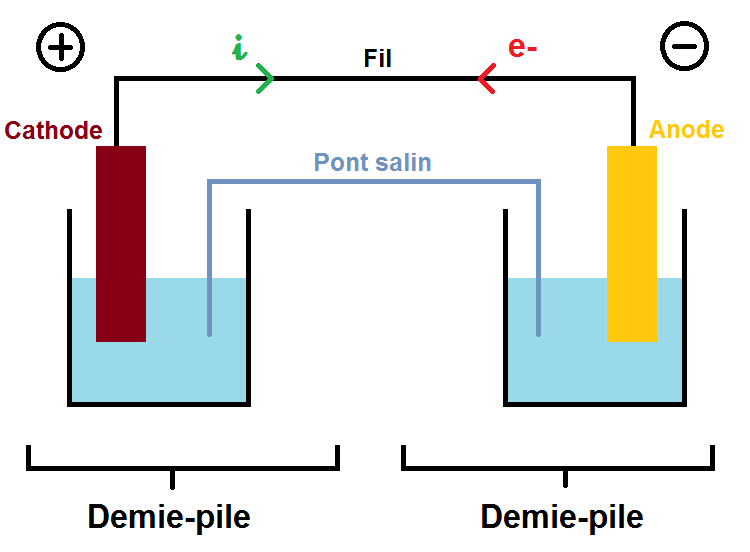
Ne t’inquiète pas nous allons détailler chaque élément apparaissant sur le schéma.
A noter que les deux plaques rectangulaires rouge et jaune (anode et cathode) correspondent à des plaques solides, par exemple du cuivre, du zinc, du fer etc…
En réalité le schéma n’est pas complet car il manque les entités chimiques.
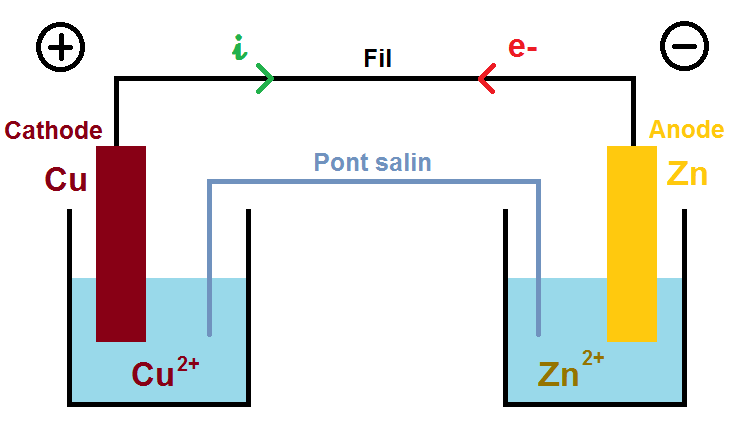
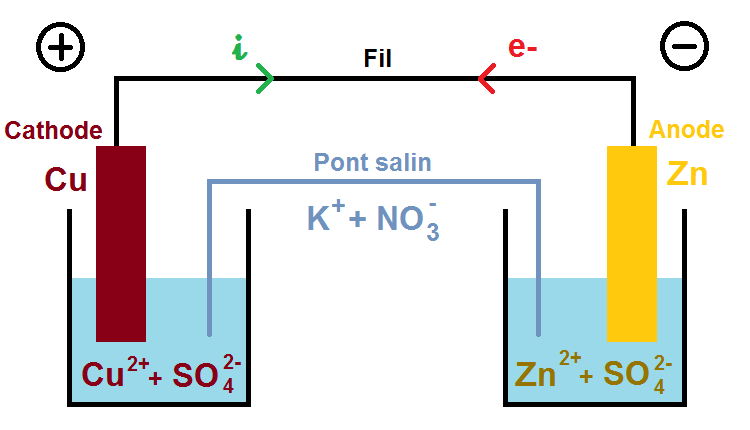
Ici nous allons supposer que l’anode est une plaque de zinc (Zn) et la cathode une plaque de cuivre (Cu). Cet exemple est le plus classique que tu rencontreras dans les exercices.
Petite remarque : le Zn et le Cu étant solides, il sont normalement notés Zn(s) et Cu(s), mais pour simplifier nous ne mettrons pas les (s), mais tu devras les mettre sur ta copie !
Les deux solides font nécessairement partie d’un couple oxydant/réducteur (qui sera donné dans l’énoncé), il s’agit ici de Zn2+/Zn et Cu2+/Cu
Les deux autre espèces (Cu2+ et Zn2+) sont forcément présentes dans les solutions dans lesquelles baignent les plaques de cuivre et de zinc, on peut donc compléter le schéma :
Les solutions étant forcément neutres, il faut des ions négatifs pour compenser les ions positifs. L’énoncé te donne les ions présents en solution, souvent des ions sulfate SO42-, ce qui donne une solution de sulfate de cuivre Cu2+ + SO42- et de sulfate de zinc Zn2+ + SO42- :
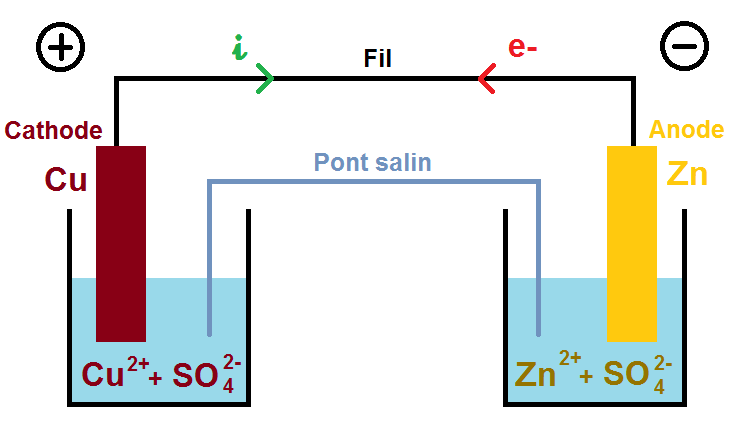
Il y a encore des espèces à rajouter sur le pont salin, mais avant cela il faut parler du sens des électrons.
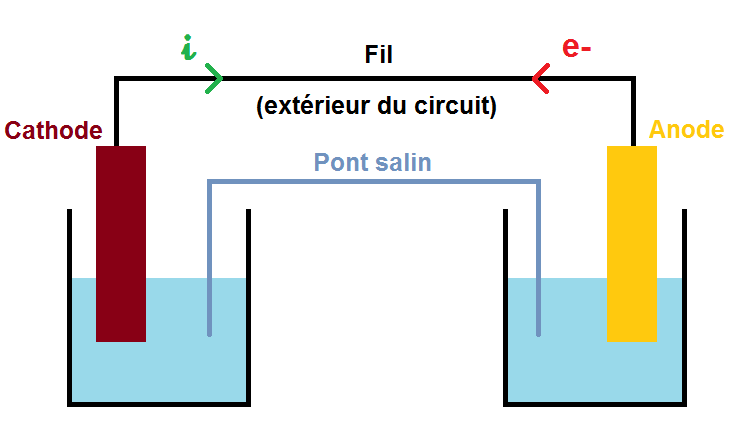
Le but d’une pile est de générer de l’électricité, mais pour cela il faut un circuit fermé. Ce circuit est représenté en pointillés sur ce schéma :
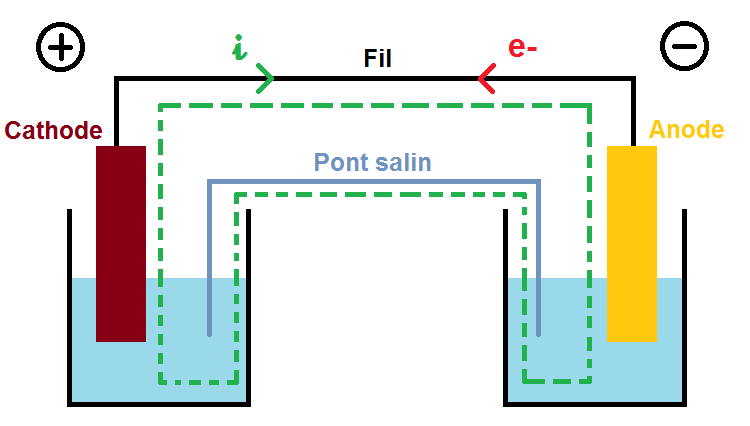
Dans le circuit, il y a un courant électrique qui est toujours opposé au sens de déplacement des électrons.
Ce courant est noté i et représenté par la flèche verte, les électrons notés e- représentés par la flèche rouge.
Comment trouver le sens des électrons ?
C’est là qu’intervient un principe à retenir avec un moyen mnémotechnique : l’anode et la cathode.
A l’anode il se passe une oxydation, et la cathode une réduction.
Pour retenir il existe non pas un mais DEUX moyens mnémotechniques pour s’en souvenir :
Anode et Oxydation commencent tous les deux par des voyelles, tandis que Cathode et Réduction commencent tous les deux par des consonnes !
Autre moyen : regarder la lettre avant le « t » !
Dans Oxydation, la lettre avant le « t » est un a, 1ère lettre du mot Anode, et dans Réduction la lettre avant le « t » est un c, 1ère lettre du mot cathode… et oui, c’est magique 
Ainsi, s’il se passe une réduction à la cathode qui est Cu, l’équation correspondante sera :
Cu2+ + 2e- → Cu
A l’inverse, si à l’anode qui est Zn il se passe une oxydation, l’équation sera :
Zn → Zn2+ + 2e-
Ainsi on voit que le Cu2+ va CAPTER des électrons (puisqu’ils sont dans les réactifs), tandis que le Zn va DONNER des électrons (puisqu’ils sont dans les produits).
Les électrons vont donc aller du Zn vers le Cu, d’où le sens de la flèche rouge sur le schéma.
Il faut préciser que les électrons vont du Zn vers le Cu en passant par l’extérieur du circuit, c’est-à-dire par le fil qui relie les deux plaques, et non par le pont salin.
A partir du sens des électrons on peut déterminer le sens du courant i qui, comme dit plus haut, est de sens opposé aux électrons :
Une fois que l’on a déterminé le sens des électrons, on peut déterminer également les bornes de la pile, c’est-à-dire la borne + et la borne -.
Le principe est simple : les électrons vont toujours du – et le +, et donc le i du + vers le -.
Dans notre exemple cela donne :
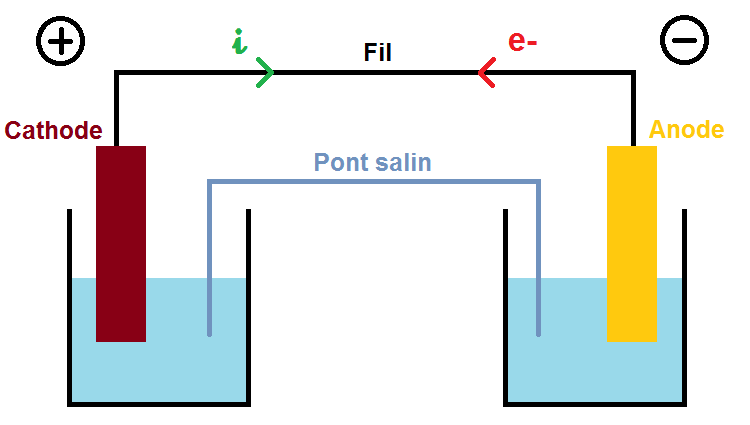
La cathode correspond donc à la borne +, et l’anode à la borne -.
Ainsi, on savait au début qui était la cathode et qui était l’anode, et on en a déduit les équations qui se passaient dans chaque demi-pile, le sens des électrons, le sens du courant, et les bornes de la pile.
Mais on peut très bien connaître un autre élément et trouver tous les autres !
On peut par exemple te donner le sens des électrons, et tu en déduis le sens du courant, les bornes de la pile, l’anode et la cathode, et les équations dans chaque demi-pile.
Si l’on récapitule cela fait 5 choses à déterminer :
– sens des électrons
– sens du courant
– bornes de la pile
– anode et cathode
– équation dans chaque demi-pile
A partir d’un seul de ces 5 éléments on peut déterminer les autres suivant les principes énoncé ci-dessus.
Les principes à retenir sont les suivants :
—
Les électrons vont du – vers le + (en passant par le fil).
Le courant i va dans le sens opposé des électrons, donc du + vers le -.
A l’anode il se passe une oxydation, et à la cathode une réduction.
L’anode correspond à la borne – et la cathode à la borne +.
—
Et n’oublie pas la petite astuce pour te rappeler :
—
Anode = OxydAtion (commencent par une voyelle)
Cathode = RéduCtion (commencent par une consonne)
Tu peux aussi regarder la lettre avant le t qui correspond à la 1ère lettre du mot.
—
Maintenant que l’on a vu tout cela nous allons pouvoir parler du pont salin.
Le pont salin est généralement une bande de papier spécial imbibée d’une solution contenant des ions positifs (cations) et des ions négatifs (anions).
Nous allons prendre un exemple que tu rencontreras assez souvent : le nitrate de potassium (K+ + NO3–) :
Reprenons les équations se passant dans chaque demi-pile :
Cu2+ + 2e- → Cu
Zn → Zn2+ + 2e-
On constate que la quantité de Cu2+ diminue (car il est dans les réactifs) alors que la quantité de Zn2+ (car il est dans les produits).
Or les solutions doivent rester électriquement neutres !!
Ainsi, pour compenser la diminution de Cu2+, les ions K+ vont aller dans la solution de gauche, et pour compenser l’augmentation de Zn2+ les ions NO3– vont aller dans la solution de droite :
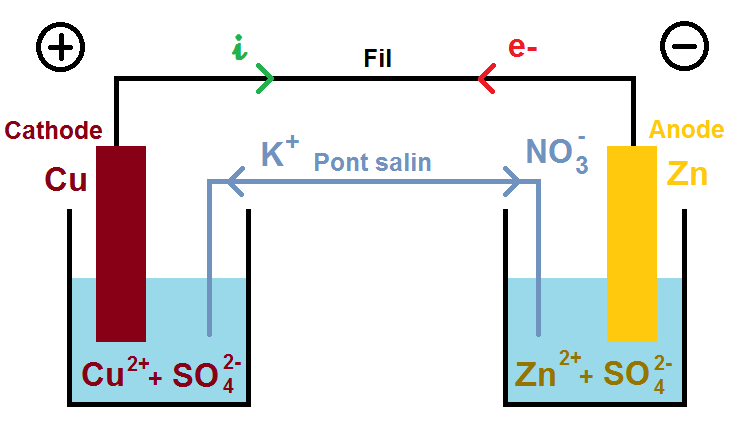
Ce déplacement d’ions correspond à un déplacement de charges (puisque les ions sont chargés), qui correspond au déplacement des électrons dans le fil.
En effet, les ions négatifs vont dans le même sens que les électrons, ce qui est logique puisqu’il s’agit d’un circuit électrique.
Ainsi le déplacement des charges est un nouvel élément que l’on peut déterminer à partir d’un des 5 éléments que l’on a vu précédemment.
Le déplacement de ces ions sert comme on l’a dit à compenser l’augmentation ou la diminution d’ions dans les solutions, c’est-à-dire à assurer l’électroneutralité des solutions.
Mais le pont salin joue également un deuxième rôle très simple : fermer le circuit !
En effet s’il n’y avait pas de pont salin il n’y aurait pas de circuit fermé, et donc le courant ne pourrait pas passer.
—
Le pont salin assure donc un double rôle : assurer l’électroneutralité des solutions et fermer le circuit.
—
Retiens bien cela car il est très souvent demandé en question de cours, aux contrôles comme au bac, le rôle du pont salin 
On a vu ci-dessus différentes manières de trouver le sens du courant (à partir du sens des électrons, des bornes de la pile etc…).
Il existe encore une autre méthode à partir d’un instrument de mesure : l’ampèremètre.
L’ampèremètre comme son nom l’indique mesure les… ampères, qui est l’unité du courant !
Cette unité se note A, par exemple i = 3A, i = -5A etc… et oui, le courant peut-être négatif !
L’ampèremètre se branche en série, c’est-à-dire sur le fil, car il compte le nombre d’électrons qui passent, il possède une borne + (notée A, que l’on branche à la borne + de la pile) et une borne – (souvent notée COM que l’on branche à la borne – de la pile) :
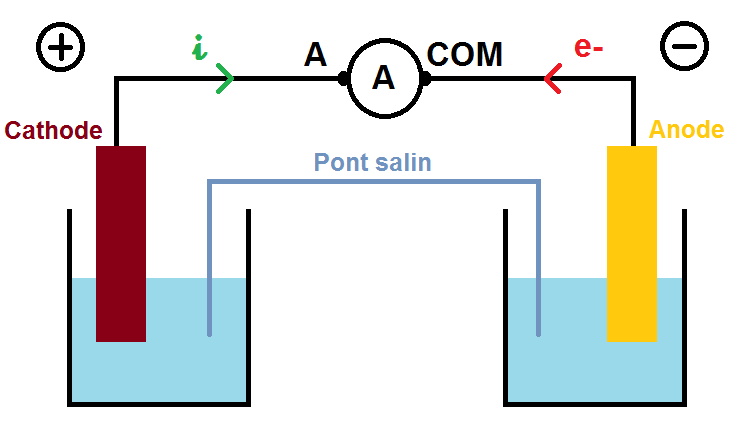
Petite remarque : le A dans le cercle indique que c’est un ampèremètre, le A en dehors du cercle indique le borne + de l’ampèremètre.
Sur le schéma la borne + de l’appareil (notée A) est bien branchée à la borne + de la pile, et réciproquement pour les bornes – : l’ampèremètre va ainsi indiquer une valeur positive !!
Par exemple 3A.
Si en revanche on avait inversé les bornes selon le schéma suivant, l’appareil aurait affiché -3A :
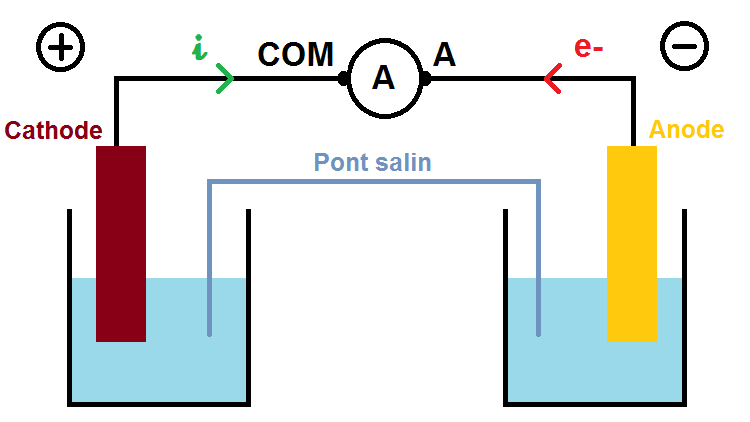
Ainsi, si l’on ne connaît aucun des éléments (anode, cathode, sens des électrons, du courant, des ions dans le pont salin etc…), on peut très bien brancher un ampèremètre sur le fil en choisissant au hasard les bornes A et COM :
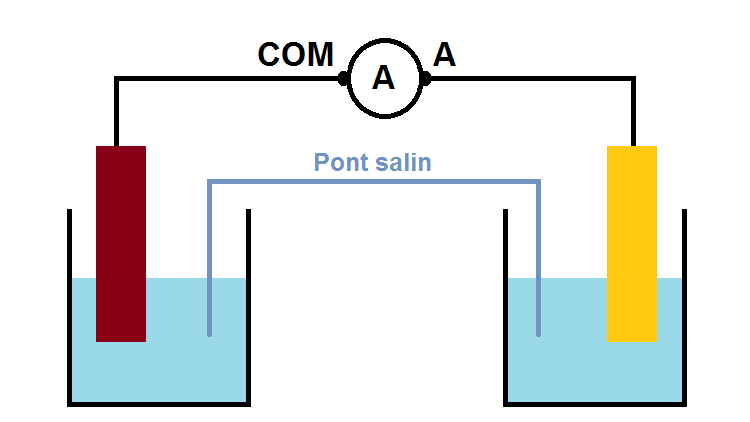
Si le résultat affiché est positif, alors le borne A est relié à la borne + de la pile et COM à la borne – de la pile, ce qui permet de connaître les bornes de la pile, puis tous les autres éléments (sens du courant, des électrons, anode, cathode etc…).
Si au contraire le résultat est négatif alors le borne A est relié à la borne – de la pile et COM à la borne + de la pile.
Par exemple, dans l’énoncé on te donne juste le schéma ci-dessus en t’indiquant que l’ampèremètre affiche un courant de -5A, ce signifie que la borne + de la pile est relié au COM, et la borne – de la pile au A :
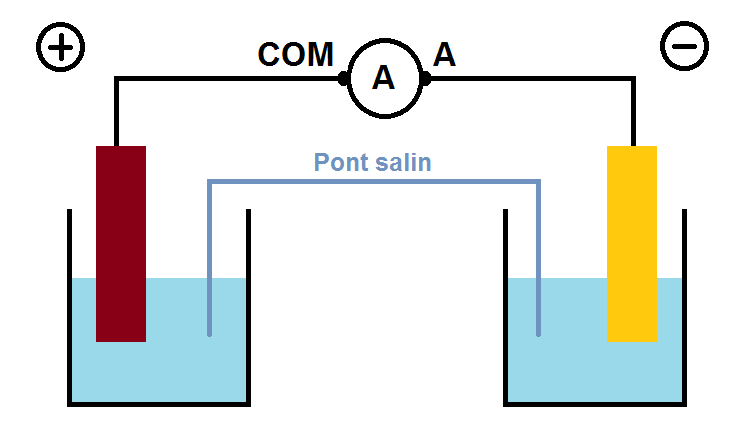
On en déduit ensuite tous les éléments (anode, cathode, sens du courant, des électrons etc…).
Si l’on reprend toujours le même exemple, on a vu que les équations qui se déroulaient étaient les suivantes :
Cu2+ + 2e- → Cu
Zn → Zn2+ + 2e-
D’après le chapitre sur l’oxydo-réduction, ces demi-équations peuvent être réunies en une seule :
Cu2+ + Zn → Zn2+ + Cu
Petite particularité cependant : Cu2+ et Zn réagissent ensemble mais ils ne sont jamais en contact !!!
En fait ils s’échangent des électrons via le fil.
De même les produits Zn2+ et Cu ne seront jamais en contact.
Ce que l’on peut dire en revanche, c’est que la quantité de Zn diminue tandis que la quantité de Cu augmente: la masse de la plaque de zinc va donc diminuer tandis que la masse de celle cuivre augmente !
Dans les exercices on peut donc te demander quelle est la masse de zinc perdue et la masse de cuivre gagnée. Pour cela tu feras un tableau d’avancement comme tu sais si bien les faire 
Nous verrons un exemple de ce type de calcul dans les exercices.
Nous allons récapituler tout ce que nous avons vu parce que tout est lié.
En effet, dans un exercice, tu devras généralement tout trouver (sens du courant, des électrons etc…) à partir d’une seule indication (par exemple qui est l’anode).
Les différents éléments qu’il faut trouver dans une pile sont :
– sens des électrons
– sens du courant
– bornes de la pile
– anode et cathode
– équation dans chaque demi-pile
– sens des ions dans le pont salin
– branchement de l’ampèremètre
Les principes à retenir qui te permettent de déterminer ces éléments sont les suivants :
—
Les électrons vont du – vers le + (en passant par le fil).
Le courant i va dans le sens opposé des électrons, donc du + vers le -.
A l’anode il se passe une oxydation, et à la cathode une réduction.
L’anode correspond à la borne – et la cathode à la borne +.
Les ions du pont salin se déplacent de telle sorte que l’électroneutralité des solutions soit assurée.
L’ampèremètre à sa borne COM reliée à la borne – de la pile et sa borne A reliée à la borne + de la pile pour afficher un courant positif, sinon il affichera un courant négatif.
—
Retiens également le double rôle du pont salin, à savoir assurer l’électroneutralité des solutions et fermer le circuit.
Et bien sûr retiens bien le schéma complet de la pile car il te sera sûrement demandé, ou tu auras au minimum à le compléter !
Les exercices sur ce chapitre sont disponibles en cliquant sur ce lien !



bonjour svp quelle est l influence sur le potentiel et la force électromotrice si on remplace le cuivre par l aluminium
merci d avance,
Bonjour, ma question est comment savoir qui est l’anode et qui est le cathode ?
Merci beaucoup pour ces explications. elles sont claires et limpides
Je pense qu’il y a une erreur : L’anode correspond à la borne + et la cathode à la borne –
et non pas l’inverse
Non c’est bien ça, l’inverse c’est pour une électrolyse.
Bonjour !
Pour commencer, je ne peux qu’être d’accord avec tous les commentaires élogieux concernant ce site, les explications sont limpides et exemples abondants. Merci pour cet excellent travail 🙂
Il me semble que la pont salin assure l’électroneutralité (comme dans les exercices) et non l’électronégativité.
Bonne continuation
Merci beaucoup ! En effet erreur corrigée 🙂
Svp quelqu’un me dit esQ la pile de Daniel debit des courants forts ou pas !? Merci d’avance
Généralement ce sont des courants faibles !
Les explications sont super merci
Très compréhensible ce cour.