Sommaire
Introduction
Principe de la dilution
Protocole expérimental
Echelle de teinte
Piège classique
Exercices
Nous allons voir dans ce chapitre la dilution et une de ses applications : l’échelle de teinte.
La dilution est souvent l’une des étapes des TP de chimie donc retiens bien le protocole et les calculs qui s’y rapportent !
Attention à ne pas confondre la dilution avec la dissolution, qui fait l’objet d’un chapitre spécifique sur la dissolution.
La dilution consiste à… diluer une solution, c’est-à-dire rajouter un solvant afin de diminuer sa concentration.
Nous prendrons toujours de l’eau pour les dilutions, donc le solvant sera toujours de l’eau.
Le principe est simple : on a une solution avec une certaine concentration. On rappelle que :
C est la concentration en mol.L-1
n est la quantité de matière en mol
V est le volume en L.
Les trois sont liés par la relation : n = C × V
On va rajouter de l’eau dans cette solution, le volume va donc augmenter, on peut le noter V’.
En revanche, la quantité de matière ne va pas varier !!
En effet, s’il y avait 2 mol de cuivre par exemple dans la solution, il y en aura toujours 2 mol après avoir rajouté l’eau.
Ainsi, la quantité de matière ne varie pas au cours de la dilution, seul le volume change (et la concentration évidemment)
Ce principe est très important car c’est celui que l’on utilisera pour faire les calculs.
On peut schématiser cela, les points rouges représentant la quantité de matière :
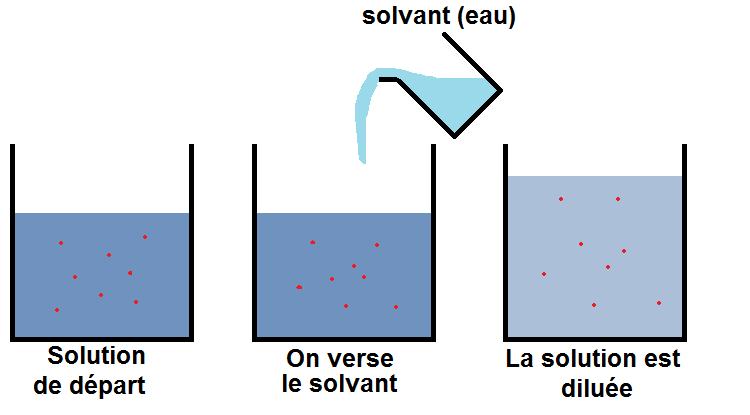
Tu remarques que la nombre de points rouges (la quantité de matière) n’a pas changé, puisqu’il n’y a pas eu de réaction.
En revanche, le volume a augmenté (puisque l’on a versé de l’eau), les points rouges ont donc beaucoup plus de places qu’avant (et ils sont toujours autant), donc la concentration a diminué.
On remarque également que la teinte de la solution s’est éclaircie (puisqu’elle est moins concentrée). Cela n’est valable que si la solution est colorée au départ évidemment (ce principe sera utilisé dans l’échelle de teinte).
La solution de départ est appelée solution mère.
La solution finale est appelée solution fille.
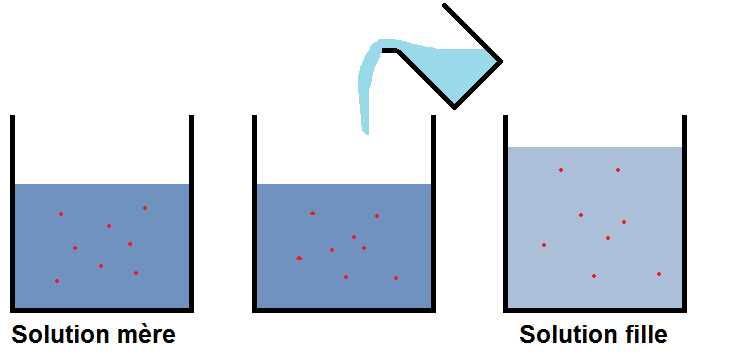
On va alors utiliser les notations suivantes :
pour les concentrations : Cmère et Cfille
pour les volumes : Vmère et Vfille
pour la quantité de matière : nmère et nfille
Sauf que l’on a vu plus haut que la quantité de matière ne variait pas !
Donc :
\(\textstyle n_{mere} = n_{fille} \)
\(\textstyle C_{mere} \times V_{mere}= C_{fille} \times V_{fille} \)
Au cours d’une dilution, on a donc :
\(\displaystyle C_{mere} \times V_{mere}= C_{fille} \times V_{fille} \)
Cette formule est impérativement à savoir car on s’en servira tout le temps lors des exercices!!
Comme le volume a augmenté au cours de la dilution : Vfille > Vmère.
Donc d’après la formule, on a bien Cfille < Cmère, ce qui est logique avec ce que l’on a vu précédemment 
Avant de voir le protocole pour effectuer une dilution, parlons du facteur de dilution, noté f (ou F).
On a :
\(\displaystyle f = \frac{C_{mere}}{C_{fille}} \)
D’après la formule vue plus haut, on a donc aussi :
\(\displaystyle f = \frac{V_{fille}}{V_{mere}} \)
Comme Vfille > Vmère, on a donc f > 1.
Prenons un exemple : f = 10.
Cela signifie que la solution fille sera 10 fois moins concentré que la mère, et que son volume sera 10 fois plus important.
Ainsi, si on a 2 L de solution mère à 25 mol.L-1, cela signifie que l’on aura 20 L de solution fille à 2,5 mol.L-1
(ces valeurs ne sont pas très réalistes par rapport à ce que tu auras en TP ou en exercices mais c’est juste pour t’expliquer le principe  ).
).
Autre exemple : f = 6
Cela signifie que la concentration de la solution fille est 6 fois moins importante.
Si la solution mère a une concentration C0, celle de la fille sera C0/6, quel que soit le volume de solution que l’on a. Nous appliquerons cela plus tard dans l’échelle de teinte.
Voyons maintenant comment réaliser concrètement une dilution.
Les grandes étapes du protocole de dilution sont les suivantes :
– prélever un volume Vmère de solution mère
– verser ce volume dans un récipient adéquat
– compléter avec de l’eau jusqu’à atteindre un volume Vfille et homogénéiser
Nous allons détailler chacune de ces étapes avec des schémas en précisant la verrerie utilisée.
1ère étape : prélever un volume Vmère de solution mère.
Retiens tout d’abord qu’on ne prélève jamais directement la solution mère dans un flacon!!!
Il faut d’abord verser la solution mère dans un bécher, et ensuite prélever la solution mère dans ce bécher.
Pour savoir quel volume de solution il faut prélever, il faut d’abord calculer Vmère avec les formules vues plus haut (on donnera dans les exercices des exemples de calcul).
On prend alors une pipette jaugée avec une propripette (ou une poire à pipeter) pour prélever ce volume.
En effet, le volume prélevé devant être précis, il faut une pipette jaugée et non graduée (dès que le volume doit être précis il faut quelque chose de jaugé, pas gradué).
Si on doit prélever 10 mL de solution mère, on prendra une pipette jaugée de 10 mL.
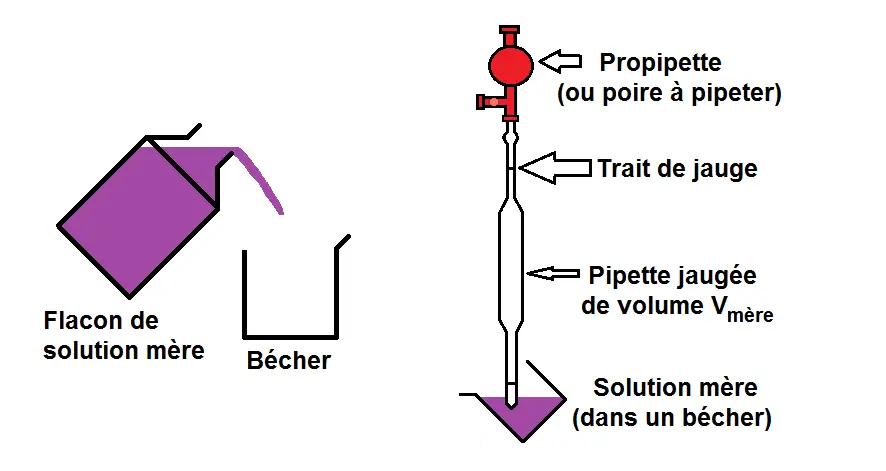
Tu remarqueras que le bécher est penché pour le prélèvement afin que ce soit plus pratique mais ce n’est pas obligatoire.
Quand tu prélèves, fais attention au ménisque et au défaut de parallaxe !
En fait, au niveau du trait de jauge, le liquide ne va pas être plat mais arrondi : c’est ce qu’on appelle le ménisque :
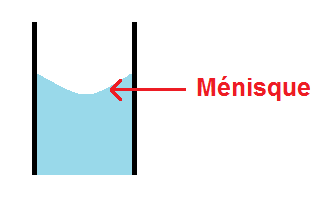
La règle est la suivante : le bas du ménisque doit être au niveau du trait de jauge :
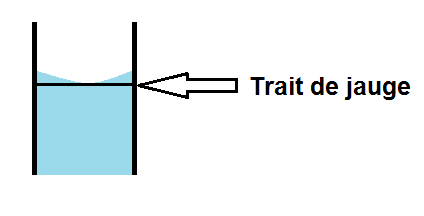
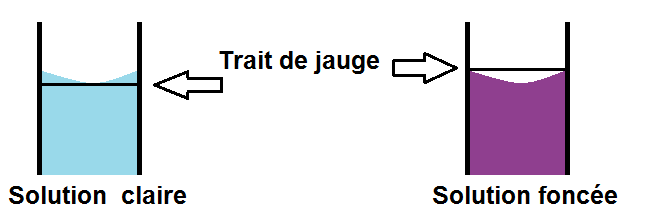
Il existe cependant une exception : pour les solutions foncées.
En effet, si la solution est trop foncée, tu ne pourras pas voir le trait de jauge. Pour les solutions foncées, on prend donc le trait de jauge en haut du ménisque :
Il faut faire également attention au défaut de parallaxe, c’est-à-dire qu’il faut mettre l’œil en face du trait de jauge :
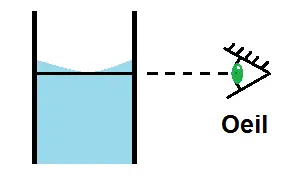
Pour éviter le défaut de parallaxe, l’œil doit être en face du trait de jauge
2ème étape : verser ce volume dans un récipient adéquat
Une fois que l’on a prélevé la solution mère avec la pipette, il va falloir verser cette solution quelque part, mais pas n’importe où !
Il faut la verser dans un erlenmeyer jaugé de volume Vfille.
En effet, le volume doit être précis donc il faut quelque chose de jaugé, en l’occurrence un erlenmeyer.
Il faut donc déjà connaître Vfille ou le calculer avec les formules vues précédemment.
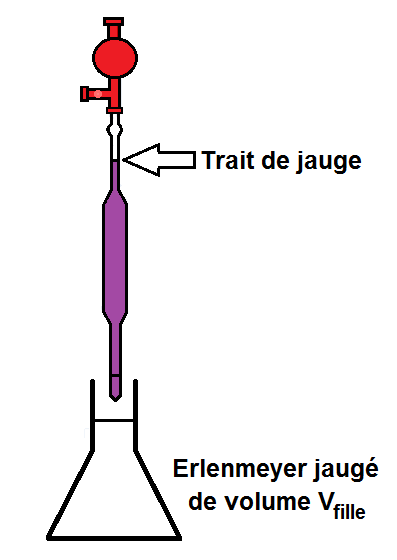
ATTENTION cependant, il ne faut pas verser toute la pipette !!
En effet, il y a un 2ème trait de jauge en bas de la pipette pour définir le volume. Si la pipette est jaugée à 15 mL, ces 15 mL correspondent au volume compris entre les deux traits de jauge.
Il faut donc vider la pipette jusqu’au trait de jauge du bas, toujours en faisant attention au ménisque et au défaut de parallaxe :
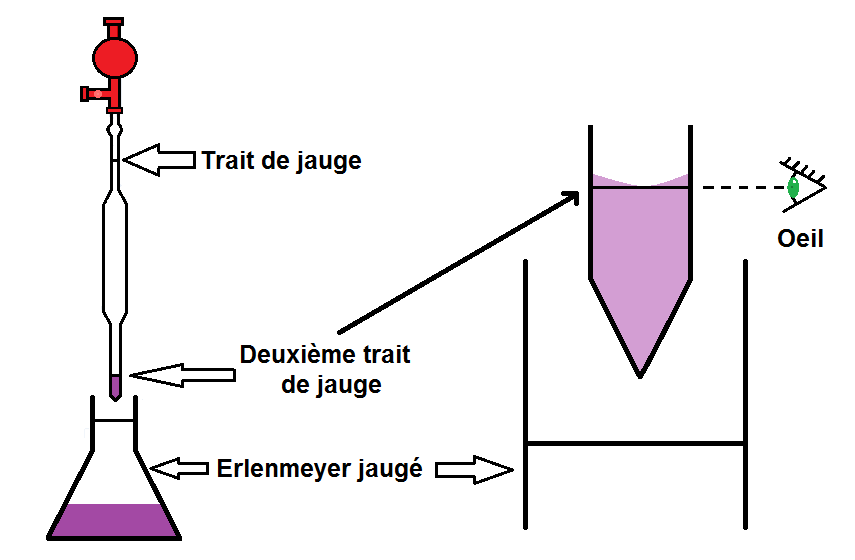
3ème étape : compléter avec de l’eau et homogénéiser
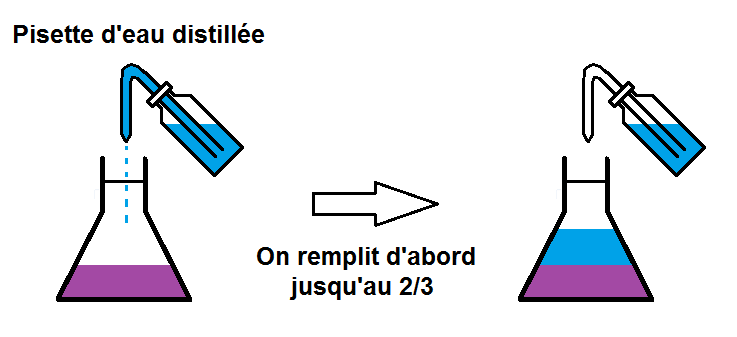
Il va maintenant falloir compléter l’erlenmeyer jusqu’au trait de jauge avec le solvant, en l’occurrence l’eau, avec une pissette.
Mais cela ne vas pas ce faire en une mais deux étapes.
En effet, on va d’abord compléter avec de l’eau distillée jusqu’au 2/3 du volume.
On va ensuite agiter pour homogénéiser (mélanger la solution et l’eau).
Après seulement on complète jusqu’au trait de jauge de l’erlenmeyer (toujours en faisant attention au ménisque et au défaut de parallaxe).
On homogénéise à nouveau.
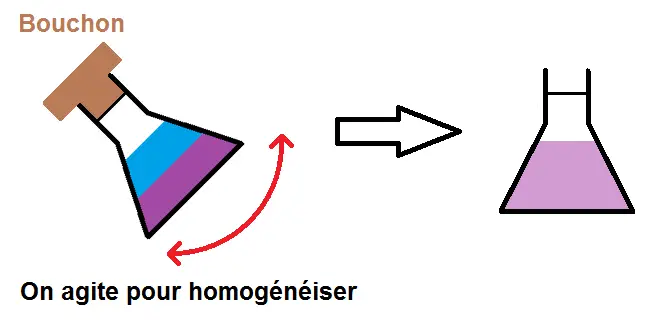
Pense bien à mettre le bouchon !!
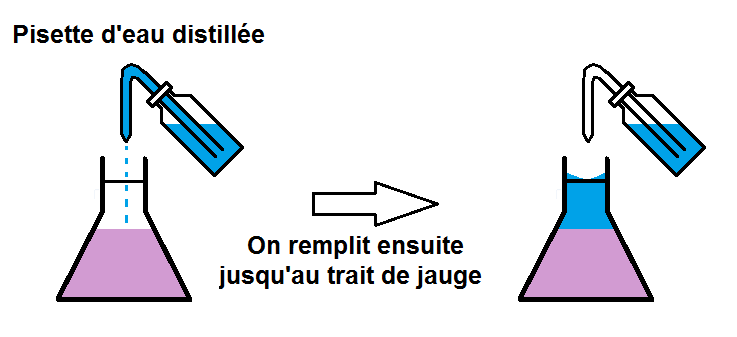
Attention au ménisque et au défaut de parallaxe !
Et voilà, on a notre solution fille 
Nous avons récapitulé les principales étapes pour que tu aies une idée plus générale du protocole :
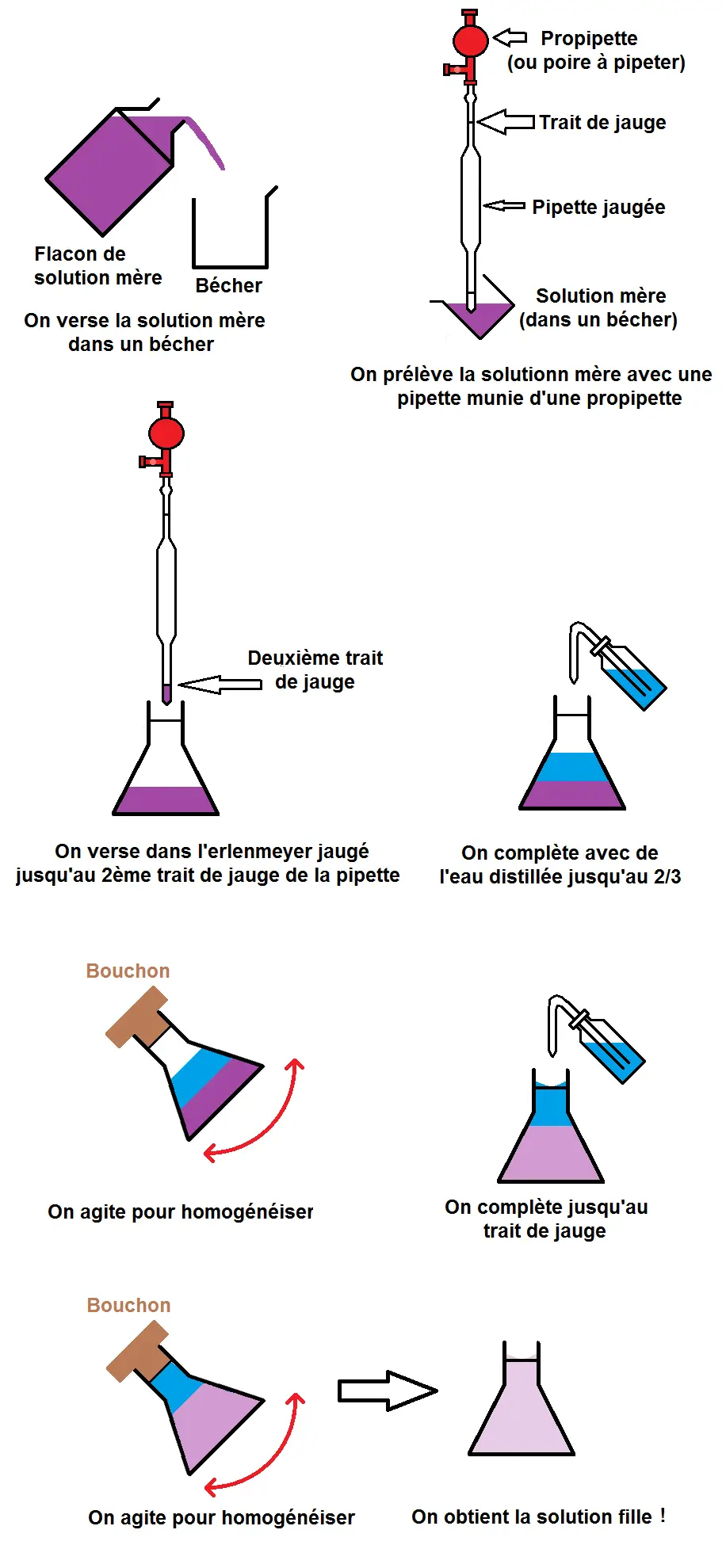
Apprends bien toutes ces étapes (avec les schémas correspondants) car tu auras à les faire en TP mais on peut également te demander le protocole en contrôle ou au bac.
L’échelle de teinte est une technique qui permet de trouver la concentration d’une solution en faisant intervenir la dilution.
Prenons par exemple une solution de permanganate de potassium de concentration inconnue. Celle-ci est violette à cause des ions permanganate (MnO4–).
On a en revanche une autre solution de permanganate de potassium de concentration
C0 = 1,00 × 10-2 mol.L-1 :
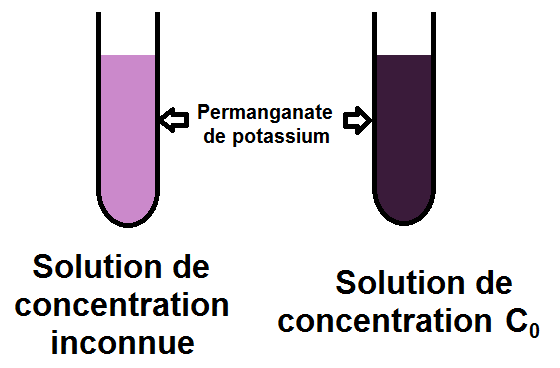
Les deux solutions n’ont pas la même couleur car elles n’ont pas la même concentration.
On a vu en effet que plus une solution est concentrée, plus elle est foncée.
La solution de concentration connue est ici plus concentrée que notre solution de concentration inconnue.
On va donc diluer cette solution connue mais avec plusieurs facteurs de dilution.
On aura ainsi différentes couleurs (car différentes concentrations), et on regardera de quelle teinte se rapproche le plus notre solution inconnue.
Cela implique donc de faire plusieurs dilutions.
On va par exemple faire 5 dilutions : la première avec un facteur 2, une autre avec un facteur 3, les autres avec un facteur 5, 8 et 10 (on peut très bien prendre d’autres valeurs).
Les concentrations respectives de ces solutions seront donc C0/2, C0/3, C0/5, C0/8 et C0/10.
—
Remarque : en réalité on ne peut pas prendre n’importe quel facteur de dilution.
En effet, on a vu que f = Vfille/Vmère.
Si l’on veut un facteur de dilution de 8, il faut donc un erlenmeyer jaugé (Vfille) 8 fois plus grand qu’une pipette jaugée (Vmère). Par exemple une pipette jaugée de 10 mL et un erlenmeyer jaugé de 80 mL.
C’est possible mais tout dépend de la verrerie dont tu disposes !
—
On va donc avoir 6 teintes (les 5 diluées + la solution connue) que l’on va ranger de la moins concentrée à la plus concentrée (on aurait pu faire dans l’autre sens) dans des tubes à essais.
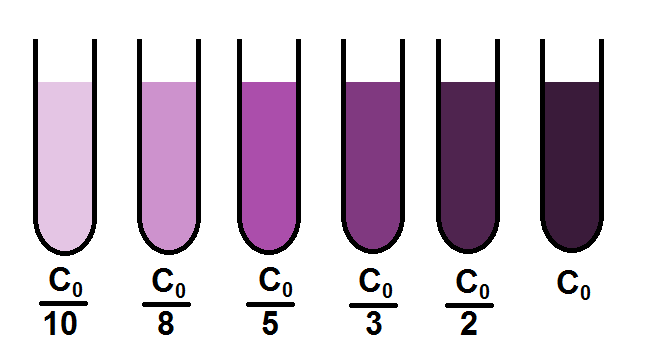
Il n’y a plus qu’à comparer avec la teinte inconnue dont on cherche la concentration :
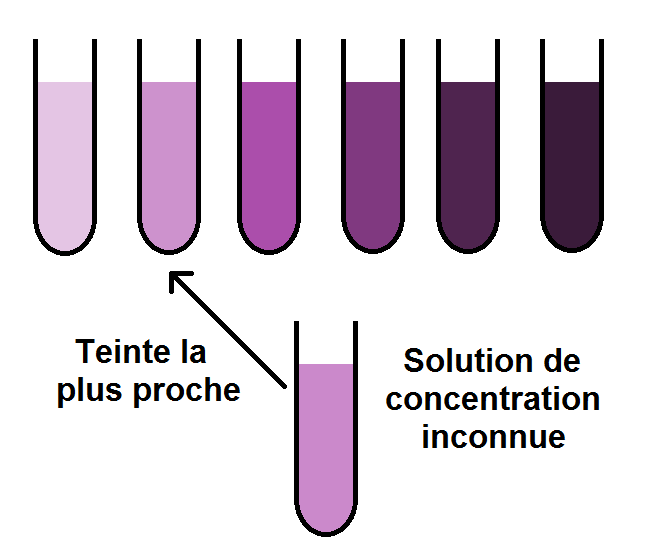
On voit que la couleur de notre solution inconnue se rapproche le plus du 2ème tube à essais, celui de concentration C0/8.
Mais ATTENTION ! Cela ne veut pas dire que la solution inconnue a une concentration de C0/8 !
En effet, la teinte n’est pas nécessairement exactement la même. C’est le cas ici, la solution inconnue est légèrement plus claire que celle de concentration C0/8.
On peut donc dire que la concentration de notre solution inconnue est proche de C0/8, elle est même légèrement inférieure, mais on ne peut pas la déterminer avec précision, ce pourquoi cette technique est un peu limitée.
Il arrive parfois que la teinte de la solution inconnue soit comprise entre 2 teintes de tubes à essais.
Dans notre exemple notre solution a une couleur comprise entre le 1er et le 2ème tube à essais, de concentration C0/10 et C0/8.
On peut alors donner un encadrement de notre concentration inconnue :
C0/10 < C < C0/8.
Si on récapitule :
– on a une solution de concentration inconnue et une autre de concentration connue ;
– on dilue la connue avec différents facteurs de dilution pour avoir différentes concentrations donc plusieurs teintes ;
– on compare la teinte de notre solution inconnue avec les autres pour voir de quoi elle se rapproche le plus : on peut alors donner une approximation ou un encadrement de la concentration inconnue.
Plusieurs limites cependant :
– la solution doit être colorée (sinon on ne va pas voir grand chose…) ;
– on ne peut pas faire n’importe quel facteur de dilution (tout dépend de la verrerie dont on dispose) ;
– il faut effectuer plusieurs dilutions (cela peut prendre du temps) ;
– la détermination de la concentration inconnue n’est pas précise.
Maintenant que tu connais tout sur la dilution il ne te reste plus qu’à t’entraîner en TP ! 
Avant de passer aux exercices, voyons un piège classique que tu rencontreras souvent en contrôle et au bac.
On a une solution S0 de concentration C0 inconnue.
Cette solution étant trop concentrée, on la dilue 50 fois pour obtenir une solution S1.
Avec différentes techniques (titrage, spectrophotométrie etc…) on arrive à déterminer la concentration C1 de la solution S1, on trouve C1 = 1,20 × 10-2 mol.L-1.
On te demande d’en déduire la concentration de S0.
Quand on dit « on la dilue 50 fois », cela signifie que le facteur de dilution est 50.
Ainsi f = 50 : C0/C1 = 50.
Donc C0 = 50 × C1
C0 = 50 × 1,20 × 10-2
C0 = 6,00 × 10-1 mol.L-1.
Cela a peut-être l’air simple sauf qu’il y a généralement plusieurs questions voire des graphiques entre le moment où il est dit que l’on dilue 50 fois et le moment où on te demande la concentration, surtout que l’énoncé est parfois volontairement flou.
Beaucoup d’élèves oublient alors que la solution a été diluée et donnent comme réponse la concentration de la solution diluée et non celle de la solution initiale…
Pour ne pas tomber dans ce piège, pense à surligner sur l’énoncé le fait que la solution a été diluée car tu vas forcément devoir le réutiliser quelque part ! 
Les exercices sur ce chapitre sont disponibles en cliquant sur ce lien !



J’ai un contrôle pour demain, je n’ai pris aucune note et ce site très bien expliquée m’a tout instruit, merci!
c’est vraiment très explicatif, grand merci à vous
Infiniment pratique, gros merci!
Vous êtes des monstres, merci infiniment.
Merci beaucoup encore pour tout ce que vous nous faites ☺️🤗