Sommaire
Introduction
Acides et basess
Cas particulier : les ampholytes
Ka et pKa : diagrammes de prédominance
Lien avec le pH
Réactions acido-basiques
Le produit ionique de l’eau
Exercices
Dans ce chapitre nous allons voir ce qu’est un acide, une base, et tous les calculs et formules liés aux réactions acido-basiques.
Si tu as vu le chapitre sur l’oxydo-réduction tu vas voir quelques similitudes, nous en parlerons au fur et à mesure du chapitre.
Avant de rentrer dans le vif du sujet, sache que l’on va souvent parler dans ce chapitre de proton H+.
Mais pourquoi H+ est-il un proton ??
Tout simplement parce qu’un atome d’hydrogène H est constitué d’un proton et d’un électron, mais pas de neutron.
Si on enlève l’électron à cet atome, il va devenir un ion avec une charge positive puisqu’on lui a enlevé une charge négative, donc H+.
Et comme on lui a enlevé l’électron il ne reste plus que… le proton !
H+ correspond donc bien à un proton, ce pourquoi on parle de proton H+.
Voyons maintenant la définition d’un acide et d’une base :
—
Un acide est une espèce chimique susceptible de céder un ou plusieurs protons H+
—
—
Une base est une espèce chimique susceptible de capter un ou plusieurs protons H+
—
Ces définitions sont à retenir par cœur car elles sont très souvent demandée en question de cours, notamment au bac !
Tu remarques que la définition des deux est très similaire, si ce n’est que l’un va capter alors que l’autre va céder des protons H+ (la base va capter les protons libérés par l’acide^^).
La définition d’un acide et d’une base ressemble beaucoup à celle d’un oxydant et d’un réducteur, si ce n’est que ces derniers s’échangent des électrons et non des protons comme c’est le cas pour un acide et une base.
A chaque acide est associé une base (et donc à chaque base est associé un acide).
De la même manière que l’oxydant et le réducteur sont regroupés en couple, l’acide et la base correspondante sont regroupés dans ce que l’on appelle un couple acide/base.
De la même manière que pour oxydant et réducteur, l’acide et la base sont séparés par un /, l’acide est toujours à gauche et la base est toujours à droite.
Au lycée on ne voit que les acides et les bases qui s’échangent un seul H+.
Un acide et sa base vont donc s’échanger 1 proton H+ selon l’équation suivante :
—
Acide → Base + H+
—
Exemples : pour le couple H3O+/H2O :
H3O+ → H2O + H+
HNO3/NO3– :
HNO3 → NO3– + H+
CH3COOH/CH3COO–
CH3COOH → CH3COO– + H+
Tu as peut-être remarqué que l’acide a forcément un H+ en plus par rapport à la base.
Ainsi on note très souvent l’acide AH et la base A–
L’équation se note donc de manière générale :
—
AH → A– + H+
—
On peut également écrire l’équation en rajoutant de l’eau à gauche et à droite de l’équation, ce qui donne :
AH + H2O → A– + H+ + H2O
Or H+ + H2O = H3O+, ce qui donne :
—
AH + H2O → A– + H3O+
—
Il s’agit de la réaction de l’acide (AH) avec l’eau.
Cette réaction peut être totale ou pas.
Si la réaction de l’acide avec l’eau est totale, on dit qu’il s’agit d’un acide fort.
Si la réaction de l’acide avec l’eau n’est pas totale, on dit qu’il s’agit d’un acide faible.
—
Un acide fort est un acide dont la réaction avec l’eau est totale.
Un acide faible est un acide dont la réaction avec l’eau n’est pas totale.
—
Apprends ces définitions par cœur car elles sont souvent demandées ! 
De même, une base peut réagir avec l’eau selon la réaction suivante :
—
A– + H2O → AH + HO–
—
Cette réaction peut être totale ou pas.
Si la réaction de la base avec l’eau est totale, on dit qu’il s’agit d’une base forte.
Si la réaction de la base avec l’eau n’est pas totale, on dit qu’il s’agit d’une base faible.
—
Une base forte est une base dont la réaction avec l’eau est totale.
Une base faible est une base dont la réaction avec l’eau n’est pas totale.
—
Encore une fois ces définitions peuvent t’être demandées en contrôle ou au bac !
Voyons maintenant un cas particulier : les ampholytes.
On a vu qu’un acide donnait un proton H+ et qu’une base captait un proton H+.
Mais il existe des espèces qui peuvent être à la fois acide et base : les ampholytes, aussi appelées espèces amphotères.
Bien sûr une telle espèce est l’acide d’un couple et la base d’un autre couple.
L’exemple que tu verras le plus est l’eau H2O.
H2O est à la fois l’acide du couple H2O/HO– et la base du couple H3O+/H2O
Les équations sont :
H2O → HO– + H+
H3O+ → H2O + H+
Suivant l’énoncé H2O sera soit une base soit un acide.
Autre exemple d’ampholyte : l’ion hydrogénocarbonate HCO3– qui est l’acide dans le couple HCO3–/CO32- et la base dans le couple H2CO3/HCO3–
Les équations sont :
HCO3– → CO32- + H+
H2CO3 → HCO3– + H+
Retiens bien la définition d’un ampholyte car cela peut t’être demandé en question de cours :
—
Un ampholyte, ou espèce amphotère, est une espèce chimique qui peut être à la fois acide et base.
—
Chaque couple acide/base possède une constante caractéristique appelée constante d’acidité et notée Ka, elle est sans unité.
Cette constante a pour expression :
\(\displaystyle Ka = \frac{[H_3O^{+}][base]}{[acide]} \)
Les crochets indiquent qu’il s’agit de la concentration (de la base, de l’acide et de H3O+).
L’acide étant noté AH et la base A–, Ka peut également s’écrire :
\(\displaystyle Ka = \frac{[H_3O^{+}][A^-]}{[AH]} \)
A cette constante d’acidité est associée une autre : le pKa, qui est également sans unité.
Ka et pKa sont associés par les relations suivantes:
\(\displaystyle Ka = 10^{-pKa} \)
\(\displaystyle pKa = -log(Ka) \)
Ainsi à partir du Ka on peut trouver le pKa et à partir du pKa on peut trouver le Ka.
Mais à quoi cela sert-il de connaître Ka et pKa ?
Cela sert à tracer des diagrammes de prédominance.
Il s’agit de tracer une flèche représentant le pH et de mettre la valeur du pKa dessus :
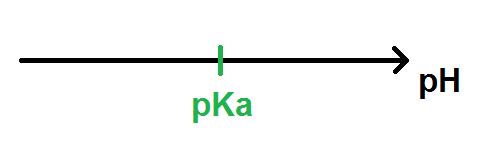
Ensuite c’est très simple :
– si pH = pKa, la base et l’acide ont la même concentration : [acide] = [base]
– si pH < pKa, l'acide prédomine donc sa concentration est supérieure : [acide] > [base]
– si pH > pKa, la base prédomine donc sa concentration est supérieure : [acide] < [base]
Le diagramme complet est donc :
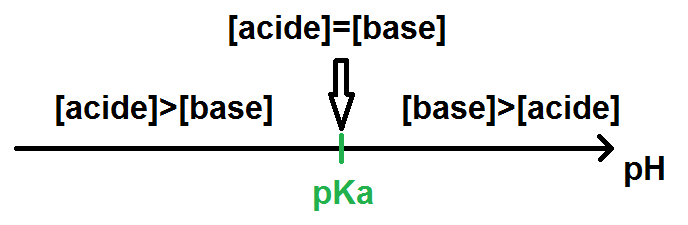
Exemple : prenons le couple NH4+/NH3, son pKa est de 9,25 et on nous demande de faire le diagramme de prédominance.
Il faut tout simplement faire le diagramme suivant :
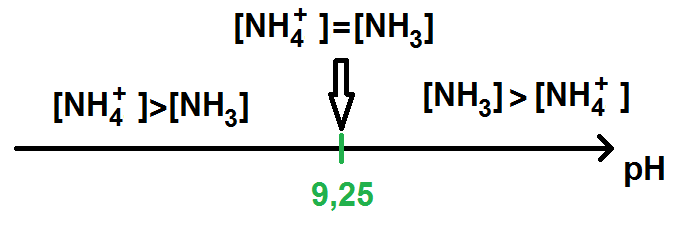
Comme tu le vois rien de compliqué 
Evidemment si on te donne le Ka du couple il faut d’abord calculer le pKa avec la formule pKa = -log(Ka) et seulement après faire le diagramme.
Le pH (qui signifie potentiel hydrogène) est une grandeur sans unité qui mesure l’acidité ou la basicité d’une solution.
Le pH est compris entre 0 et 14 et on a le principe suivant :
Si pH = 7 : la solution est neutre.
Si pH < 7 : la solution est acide.
Si pH > 7 : la solution est basique.
On peut résumer cela avec un graphique :
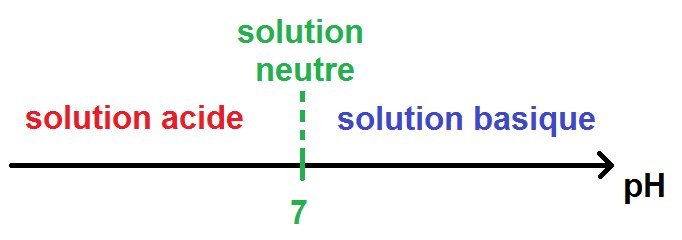
Tu remarques qu’il y a une grande similitude avec le diagramme de prédominance, sauf que c’est le 7 qui sert de « séparation » et non le pKa.
De plus, à gauche du pKa c’est l’acide qui domine, et à gauche de 7 la solution est acide.
De même, à droite du pKa c’est la base qui domine et à droite de 7 la solution est basique.
Au-delà du graphe, il y a une relation mathématique liant le pH et le pKa.
En effet, le pH se calcule de la manière suivante :
\(\displaystyle pH = -log([H_3O^{+}]) \)
Reprenons alors la relation du Ka de tout à l’heure :
\(\textstyle Ka = \frac{[H_3O^{+}][A^-]}{[AH]} \)
Prenons le log de cette relation :
\(\textstyle log(Ka) = log(\frac{[H_3O^{+}][A^-]}{[AH]}) \)
Comme pKa = -log(Ka), log(Ka) = -pKa.
De plus, en appliquant les formules de log (qui sont les mêmes que pour ln : log(ab) = log(a) + log(b)), on obtient :
\(\textstyle -pKa = log([H_3O^{+}]) + log(\frac{[A^-]}{[AH]}) \)
Multiplions tout par -1 :
\(\textstyle pKa = -log([H_3O^{+}]) – log(\frac{[A^-]}{[AH]}) \)
Comme pour ln, log(a/b) = -log(b/a), et en remplaçant -log([H3O+]) par pH, on obtient :
\(\displaystyle pKa = pH + log(\frac{[AH]}{[A^-]}) \)
On peut démontrer, on changeant légèrement la démonstration ci-dessus (que tu feras tout seul pour t’entraîner  ), que l’on obtient :
), que l’on obtient :
\(\displaystyle pH = pKa + log(\frac{[A^-]}{[AH]}) \)
Ces deux relations sont à savoir mais généralement il faut les redémontrer comme on vient de le faire ci-dessus !!
Ces relations servent à calculer soit le pH, soit le pKa, soit [AH] soit [A–] suivant ce que l’on te donne dans l’énoncé, mais cela sert également à justifier le diagramme de prédominance que l’on a vu précédemment.
En effet, si [A–]>[AH], [A–]/[AH]>1, donc log([A–]/[AH])>0 et donc pH>pKa.
A l’inverse, si [A–]<[AH], [A–]/[AH]<1, donc log([A–]/[AH])<0 et donc pH<pKa.
Enfin, si [A–]=[AH], [A–]/[AH]=1, donc log([A–]/[AH])=0 et donc pH=pKa.
On vient de démontrer que :
si [A–]>[AH] alors pH>pKa
si [A–]<[AH] alors pH<pKa
si [A–]=[AH] alors pH=pKa
Ceci est exactement le principe du diagramme de prédominance.
Tout comme une équation d’oxydo-réduction est la combinaison de deux demi-équations, une réaction acido-basique est issue de deux équations faisant intervenir deux couples acide/base.
Prenons par exemple les couples NH4+/NH3 et HCO3–/CO32-.
Écrivons les équations correspondantes :
NH4+ → NH3 + H+
HCO3– → CO32- + H+
Il faut inverser l’un des deux équations, par exemple la première, ce qui donne :
NH3 + H+ → NH4+
HCO3– → CO32- + H+
On regroupe alors les deux équations avec tous les réactifs d’un côté et tous les produits de l’autre :
NH3 + H+ + HCO3– → NH4+ + CO32- + H+
Comme il y a un H+ de chaque côté on peut les simplifier, ce qui donne :
NH3 + HCO3– → NH4+ + CO32-
Et voilà, on a notre équation acido-basique !
C’est en réalité la réaction entre l’acide d’un couple et la base d’un autre couple, qui donne l’autre base et l’autre acide.
Ainsi, si l’on a deux couples acide/base que l’on note AH1/A–1 et AH2/A–2, la réaction est :
—
AH1 + A–2 → AH2 + A–1
ou
AH2 + A–1 → AH1 + A–2
—
En effet, on ne sait pas dans quel sens va se faire la réaction, seul l’énoncé te permettra de décider.
Ce qui est important de retenir c’est le mélange entre l’acide d’un couple et la base d’un autre couple : ce n’est pas l’acide et la base du même couple qui réagissent ensemble.
Ainsi on ne peut PAS avoir AH1 + A1– → AH2 + A2–.
Avant de passer aux exercices il faut parler d’un cas particulier : le produit ionique de l’eau.
Nous avions vu précédemment que l’eau est un ampholyte, c’est-à-dire qu’elle peut être à la fois acide et base dans les couples suivants :
H2O/HO–
H3O+/H2O
D’après ce que l’on a vu précédemment sur les réactions acido-basiques, on peut très bien avoir l’eau (acide du 1er couple) qui réagit avec l’eau (la base du 2ème couple) selon la réaction :
H2O + H2O → HO– + H3O+
Soit en simplifiant :
2 H2O → HO– + H3O+
C’est ce que l’on appelle la réaction d’autoprotolyse de l’eau (auto car l’eau réagit avec elle-même).
La constante d’équilibre de cette réaction (notion qui n’est pas au programme de Terminale) est :
\(\displaystyle Ke = [H_3 O^{+}][HO^-] \)
A 25°C (ce qui sera toujours le cas dans les exercices), cette constante a pour valeur :
\(\displaystyle Ke = 1,0 \times 10^{-14} \)
—
ATTENTION ! Tu pourrais te dire que Ke étant un produit de concentrations, Ke est en mol2.L-2, alors que Ke est sans unité !!
Cela est dû au fait que la vraie formule de Ke fait intervenir des notions qui ne sont pas vues en Terminale donc ne te casse pas trop la tête avec ça, retiens juste que Ke est sans unité (retiens également la formule ci-dessus et la valeur de la constante évidemment  )
)
—
Mais à quoi sert cette constante ?
Cette constante peut servir à calculer la concentration de HO– quand on connaît celle de H3O+ et réciproquement, ce qui peut permettre de connaître le pH !
En effet, supposons que l’on ait une solution contenant des ions HO– et que l’on connaisse leur concentration, par exemple :
[HO–] = 1,5 x 10-6 mol.L-1
On cherche à connaître le pH de cette solution.
Pour cela, on va utiliser la formule pH = -log([H3O+])
Or d’après la formule du Ke, on a [H3O+] = Ke/[HO–]
D’où :
\(\textstyle pH = -log(\frac{Ke}{[HO^-]}) \)
\(\textstyle pH = -log(\frac{1,0 \times 10^{-14}}{1,5 \times 10^{-6}}) \)
\(\textstyle pH = 8,2 \)
Comme tu le vois rien de compliqué !
La valeur du Ke est souvent donnée dans l’énoncé.
Mais on te donnera parfois non pas Ke mais pKe : la formule est la même qu’entre Ka et pKa :
\(\displaystyle pKe = -log(Ke) \)
\(\displaystyle Ke = 10^{-pKe} \)
Avec ces formules tu devineras facilement que, à 25°C, on a :
\(\displaystyle pKe = 14 \)
Avec toutes ces formules, on pourrait également démontrer assez facilement (entraîne-toi à le faire) le fait que :
– pour pH = 7, [H3O+] = [HO–]
– pour pH < 7, [H3O+] > [HO–] (solution acide)
– pour pH > 7, [H3O+] < [HO–] (solution basique)
On retrouve ainsi le fait que H3O+ est caractéristique des solutions acides, tandis que HO– est caractéristique des solutions basiques.
Maintenant que tu sais tout sur les acides et la bases tu vas pouvoir t’entraîner avec les exercices !
Les exercices sur ce chapitre sont disponibles en cliquant sur ce lien !
Sommaire des coursHaut de la page



Super clair! merci beaucoup pour les définitions et les schémas. un régal à lire
Waw, cette page est fantastique.
Détaillé comme j’aime.
En effet je suis en licence de bio, mais je viens d’un cursus littéraire, et tout ce qui n’est pas explicité dans mes cours l’est ici. C’est agréable de comprendre enfin.
Merci.
Bonsoir. Merci pour les explications,j’aimerais bien adhérer au groupe car je trouve vos explications plus explicite et simple.
Bonjour;
ça fait trente ans que j’ai passé mon bac, et aujourd’hui c’était le tour de mon fils; et en discutant, il m’a informé qu’il a eu des questions sur le Pka. J’ai pas trouvé mieux que de faire des recherches et je suis tombé sur votre site. Je tiens à vous en féliciter. C’est simple et explicite. Bon courage et bonne continuation
Mr AHANDOUR MAROC
Merci beaucoup, bonne continuation à vous également !
Bonjour, tout d’abord, merci infiniment pour vos cours, extrêmement clairs et détaillés. J’aurais une question concernant l’equation qui amène à trouver la relation entre ph et pka\ka : pourquoi passer vous de log(Ka)=log( [H3O+][A-]|[AH]) à -pka=log[H3O+]+log[A-|AH]? Est ce que ça ne devrait pas être -pka=log[H3O+|AH] + log[A-|AH] puisque le H3O+ se trouve également dans la fraction divisée par AH?
Merci d’avance
Merci pour ton message ! Comme c’est un produit au numérateur, le [AH] du dénominateur n’est que pour un seul des deux termes du numérateur.
De manière générale : AB/C = A x B/C ou A/C x B, mais pas A/C x B/C
Ce que j’ai compris:
– Le pKa sert à tracer le diagramme de prédominance et sert de valeur repère pour savoir quelle espèce domine ( dans une solution en termes de concentration).
– Le pH sert de curseur sur ce diagramme permettant de mesurer la prédominance.
Ce que je ne comprend pas:
– Quelle est le lien avec la comparaison du pH avec le 7 ?
Est-ce que cela veut dire que l’on peut avoir une solution basique avec une prédominance acide ?
Oui en effet on peut très bien avoir une solution acide (ph inférieur à 7) mais une base qui prédomine ou l’inverse.
Dans un couple acide/base le terme ‘ »acide » et « base » ne veut pas dire solution acide et solution basique.
Je trouve que votre site est Bien cependant il existe des erreurs dans les formules Merci.
Merci ! Quelles erreurs as-tu détectées ?
Bonjour effectivement il y a une erruer au niveau du diagramme de predominance.
Quelle erreur as-tu détectée ?
C est pas pka= pH – log ( A-/AH) ??
SI mais j’ai mis cette formule sous la forme pH = pKa + log (A-/AH), ce qui revient au même !